微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g)? ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g)? ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
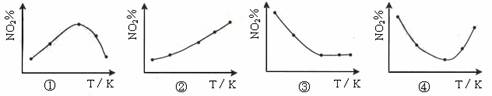
A.②④
B.②
C.①②
D.③④
参考答案:A
本题解析:因为该反应是放热反应,反应达到平衡后,升高温度平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故①错误;因为该反应是放热反应,反应达到平衡后,升高温度平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故②正确;若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,不可能出现NO2的百分含量不变的情况,故③错误;在④图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,NO2的含量增大,故④正确,因此答案选A。
本题难度:一般
2、选择题 对于A2 + 3B2 = 2C + D的反应来说,以下化学反应速率的表示中,反应速率最快的是
[? ]
A. V(B2)=0.8mol/( L·s)
B. V(D)=0.6mol/( L·s)
C. V(C )=0.6mol/( L·s)
D. V(A2)=0.8mol/( L·min)
参考答案:B
本题解析:
本题难度:简单
3、简答题 将2molSO2和1molO2混合置于容积为2L的密闭容器中,在800K时,发生如下反应:2SO2(g)+O2(g)?2SO3(g)△H<0,当反应从开始进行到5min时,反应达到平衡状态,测得混合气体总物质的量为2.1mol.请回答下列问题:
(1)800K时,该反应的平衡常数为______,在0~5min时间间隔内SO2的反应速率为______.
(2)若在5min时降低温度,在某一时刻重新达到平衡状态,则新平衡混合物中气体的总物质的量______2.1mol(填“>”、“<”或“=”),简述你的判断理由:______.
(3)若相同条件下,向该容器内分别充人xmolSO2、ymolO2和zmolSO3,反应达到平衡时,容器内混合气体总物质的量仍为2.1mol.则:x、y、z必须满足的关系是______.(一个用含x、z的式子表示,一个用含y、z的式子表示)
(4)相同条件下,若在上述容器中,充入0.2mol?SO2、0.4mol?O2和4.0molSO3三种气体,下列对该反应状态的描述中,正确的是______(填字母序号).
A.处于平衡状态?B.不是平衡状态,反应正向进行?C.不是平衡状态,反应逆向进行.
参考答案:(1)令平衡时SO2的浓度变化量为cmol/L,则:
? ?2SO2(g)+O2(g)?2SO3(g)
开始(mol/L):1? 0.5? 0
变化(mol/L):c? 0.5c? ?c
平衡(mol/L):1-c? ?0.5-0.5c? c
所以(1-c)mol/L×2L+(0.5-0.5c)mol/L×2L+cmol/L×2L=2.1mol
解得:c=0.9
故平衡时SO2、O2、SO3的浓度分别为0.1mol/L、0.05mol/L、0.9mol/L,
故平衡常数k=c2(SO3)c2(SO2)?c(O2)=0.920.12×0.05=1620,
故v(SO2)=0.9mol/L5min=0.18?mol/(L?min),
故答案为:1620;0.18?mol/(L?min);
(2)正反应是一个气体总物质的量减小的反应,且是放热反应,当降低温度时,平衡向正反应方向移动,达新平衡时,混合气体的总的物质的量减小,
故答案为:<;正反应是一个气体总物质的量减小的反应,且放热,当降低温度时,平衡向正反应方向移动;
(3)恒温恒容下,反应前后气体的物质的量发生变化,按化学计量数转化为左边,满足n(SO2)=2mol、n(O2)=1mol即可,由方程式?2SO2(g)+O2(g)?2SO3(g)可知,zmolSO3完全转化可得SO2为zmol,可得O2为0.5zmol,故满足x+z=2、y+0.5z=1,
故答案为:x+z=2、y+0.5z=1;
(4)充入0.2mol?SO2、0.4mol?O2和4.0molSO3三种气体,此时浓度商Qc=(4mol2L)2(0.2mol2L)2×0.4mol2L=2000>1620,不是平衡状态,反应逆向进行,故选C.
本题解析:
本题难度:一般
4、选择题 对平衡体系CO2 (g) CO2(aq)? ΔH=-19.75kJ·mol-,为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应采取的方法是
CO2(aq)? ΔH=-19.75kJ·mol-,为了减小温室效应的产生,增大二氧化碳气体在水中的溶解度,应采取的方法是
A.升温增压
B.降温减压
C.升温减压
D.降温增压
参考答案:D
本题解析:减小温室效应的发生即是使二氧化碳气体尽可能多地进入溶液,使平衡向右移动,反应是放热反应且气体分子数减小的反应,所以应采取的措施是降温加压。
点评:勒沙特列原理在生产生活中的运用。
本题难度:一般
5、选择题 已知A+3B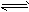 2C+D在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
2C+D在某段时间内以A的浓度变化表示的化学反应速率为1mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
[? ]
A.0.5mol·L-1·min-1
B.1mol·L-1·min-1
C.2mol·L-1·min-1
D.3mol·L-1·min-1
参考答案:C
本题解析:
本题难度:简单