微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)完成下列各题:(1).在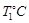 时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g)
时,向容积为2L的密闭容器甲中加入1molN2、3molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g);
2NH3(g);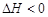 ,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得NH3的物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为?N2的转化率为?
②在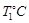 时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为(?)(填选项字母)
时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molNH3,则达到平衡时NH3的物质的量为(?)(填选项字母)
a?大于0.4mol? b?等于0.4mol? c?小于0.4mol
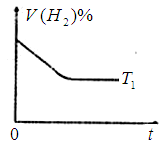
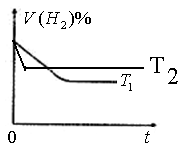
③下图是在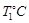 时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在
时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在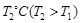 时的H2体积分数随时间t的变化曲线。
时的H2体积分数随时间t的变化曲线。
(2).已知:Al3 +与HCO3–、CO32–、HS-、S2-等能发生彻底的
双水解,生活中通常利用Al3 +与HCO3–的反应来制作泡沫灭火器。泡沫灭火器的简易构造如下图,a为玻璃瓶,b为铁筒,请思考:
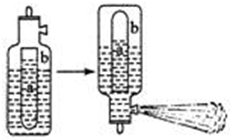
①参与反应的液体分别为Al2(SO4)3和NaHCO3,请问a瓶中盛放的液体为:?。
②为了保证泡沫灭火器的使用寿命,通常在Al2(SO4)3溶液中加入另一种物质抑制硫酸铝的水解,请问该物质是?。
③已知苯酚是比碳酸更弱的酸,请问,苯酚钠和硫酸铝能否发生彻底的双水解?如能,请写出该反应的离子反应方程式:?。
参考答案:(1)① 0.03mol·L-1 ·min-1? 20%?
②? b?③画在图上?(2)①Al2(SO4)3?②H2SO4
③?能? Al3++3C6H5O-+3H2O=Al(OH)3+3C6H5OH↓
本题解析:(1)①反应速率通常用单位时间内浓度的变化量来表示,平衡时氨气的物质的量是0.4mol,所以消耗氢气是0.6mol,氮气是0.2mol,因此其反应速率为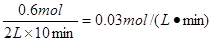 。氮气的转化率为
。氮气的转化率为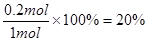 。
。
②根据方程式可知0.5molN2、1.5 molH2、1 molNH3相当于1mol氮气和3mol氢气,因此平衡是等效的,所以氨气的物质的量还是0.4mol。
③因为反应是放热反应,所以升高温度,反应速率增大,到达平衡的水解缩短。但平衡向逆反应方向移动,氢气的含量增大,因此图像为
(2)①因为硫酸铝水解显酸性,会腐蚀铁,所以a中放的是硫酸铝,b中放的是碳酸氢钠。
②硫酸铝水解显酸性,因此要抑制其水解,需要加入稀硫酸。
③酸越弱,相应的盐越容易水解,因此苯酚钠和硫酸铝能彻底水解,方程式为Al3++3C6H5O-+3H2O=Al(OH)3+3C6H5OH↓。
本题难度:一般
2、选择题 下列理解不正确的是( )。
A.化学平衡是一个动态平衡
B.化学平衡研究的对象主要是可逆反应
C.化学反应速率是研究化学反应进行的快慢问题,化学平衡是研究化学反应进行的限度问题
D.化学反应达到平衡时,正反应和逆反应速率相等,是对反应中不同物质而言
参考答案:D
本题解析:化学反应达到平衡时,对同种物质而言,其生成速率和消耗速率相等,D错。
本题难度:简单
3、选择题 在一定条件下将1mol的CO和1mol H2O(g)放入密闭容器中发生反应:CO(g)+H2O(g) 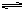 CO2(g)+H2(g),达到平衡时测得CO2为0.6mol。再通入4mol H2O(g),达到新平衡后,CO2的物质的量为
CO2(g)+H2(g),达到平衡时测得CO2为0.6mol。再通入4mol H2O(g),达到新平衡后,CO2的物质的量为
A.小于0.6mol大于0.4mol
B.等于1mol
C.大于0.6mol,小于1mol
D.大于1mol
参考答案:C
本题解析:达到平衡后再通入4mol H2O(g),增大反应物浓度,平衡正向移动,所以CO2的物质的量增加,大于0.6mol。但作为可逆反应,反应物不能全部转化,所以“1mol的CO”不能完全反应,故CO2的物质的量小于1mol。故选C
本题难度:简单
4、选择题 恒温、体积为1L的密闭容器中,充入2molPCl3和1molCl2发生下述反应:
PCl3 (g)+ Cl2(g) 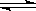 PCl5 (g)
PCl5 (g)
达到平衡时,PCl5为0.4mol。如果从体系中移走1molPCl3和0.5molCl2,重新达到平衡时,PCl5的物质的量为
A.0.15 mol
B.0.2 mol
C.0.24 mol
D.0.48 mol
参考答案:A
本题解析:略
本题难度:一般
5、填空题 (14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  ?CH3OH(g);ΔH =-90.8 kJ·mol-1
?CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  ?CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
?CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  ?CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
?CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  ?CH3OCH3(g) + CO2 (g)的ΔH= ___________;
?CH3OCH3(g) + CO2 (g)的ΔH= ___________;
(2)已知反应②2CH3OH(g)  ?CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
?CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
| CH3OH
| CH3OCH3
| H2O
|
浓度/(mol·L-1)
| 0.44
| 0.6
| 0.6
|
①比较此时正、逆反应速率的大小:v正 ______ v逆(填“>”、“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
(3)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为 、
、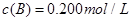 及
及 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。

请回答下列问题:
与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;______________________________________________;
③_______________________________________________;
该反应的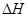 _________0,判断其理由是__________________________________;
_________0,判断其理由是__________________________________;
参考答案:(1) -246.4kJ·mol -1?(2) ①>?②0.04 mol·L-1 ?0.16 mol·L-1·min-1
(3)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变
③温度升高;达到平衡的时间缩短,平衡时A的浓度减小
﹥;升高温度向正方向移动,故该反应是吸热反应
本题解析:(1)考查盖斯定律的应用。观察目标方程式可知,①×2+②+③,即得到3H2(g) + 3CO(g)  ?CH3OCH3(g) + CO2 (g),故△H=2△H1+△H2+△H3="-246.4kJ·" mol -1。
?CH3OCH3(g) + CO2 (g),故△H=2△H1+△H2+△H3="-246.4kJ·" mol -1。
(2)此时的浓度商Q=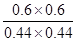 =1.86<400,反应未达到平衡状态,向正反应方向移动,故
=1.86<400,反应未达到平衡状态,向正反应方向移动,故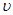 正>
正>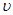 逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400=
逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400=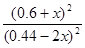 ,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
由表可知,甲醇的起始浓度度为(0.44+1.2) mol·L-1="1.64" mol·L-1,其平衡浓度为0.04 mol·L-1,
10min变化的浓度为1.6 mol·L-1,故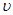 (CH3OH)="0.16" mol·L-1·min-1。
(CH3OH)="0.16" mol·L-1·min-1。
(3)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率,再由于③和①相比达平衡所需时间短,平衡时浓度更小,故不可能是改用催化剂,而只能是升高温度来影响反应速率的
③由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,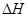 ﹥0。
﹥0。
本题难度:一般