|
|
|
高中化学必备知识点《原电池原理》答题技巧(2017年最新版)(七)
2017-08-22 16:08:51
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是
A.电池的正极反应式为:O2十2H2O十4e-=4OH-
B.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
C.电解后c(Na2CO3)变小
D.电池中c(KOH)不变;电解池中溶液pH变大
|
2、填空题 某物质A的产量可以用来衡量一个国家的石油化工发展水平。其 与水加成的产物B是一种常用的有机溶剂,在生活中有重要的应用。
(1)A的电子式为________,B的分子式为________。
若用B与O2制成燃料电池,并以稀硫酸溶液为电解质溶液,回答(2)-(5)题:
(2)负极上的电极反应式为_______________________________________。
(3)消耗标准状况下的5.6 L O2时,有__________mol电子发生转移。
(4)开始放电时,正极附近溶液的pH__________(填“增大”、“减小”或“不变”);
(5)溶液中H+由___________区向__________区移动(填“正极”或“负极”)。
3、选择题 有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀H2SO4中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4中,电流由D→导线→C;
③A、C用导线相连后,同时浸入稀H2SO4中,C极产生大量气泡;
④B、D用导线相连后,同时浸入稀H2SO4中,D极发生氧化反应。据此判断四种金属的活动性顺序为(?)
A.A>B>C>D?B.A>C>D>B
C.C>A>B>D?D.B>D>C>A
4、填空题 (18分)C、O、Na、Al、S、Cl是常见的六种元素
(1)C元素位于元素周期表第 周期,第 族;C元素的一种同位素可以测定文物年代,这种同位素的符号为
(2)用“大于”“小于”或“等于”填空
离子半径
| 还原性
| 得电子能力
| N3- Al3+
| O2- S2-
| 35Cl 37Cl
|
(3)①CaCO3和适量HCl溶液反应时,每产生4.4 g 气体(不考虑气体溶解),放热a kJ,则该反应的热化学方程式为 。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示
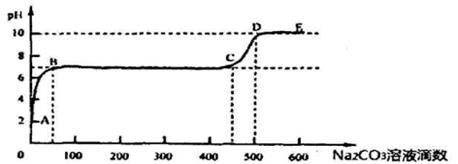

请用离子方程式表示B-C段发生的反应:
(4)氢气、氧气常用来作燃料电池,写出电解质为氢氧化钠溶液时负极上的电极方程式
5、填空题 (本题共8分)
水煤气法制甲醇工艺流程框图如下
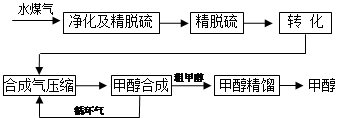
(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为??; CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为??;
②下列能提高碳的平衡转化率的措施是??。
A.加入C(s)
B.加入H2O(g)
C.升高温度
D.增大压强
|
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4 (g)+3/2O2 (g)

CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是
?(填“X”或“Y”或“Z”),选择的理由是
?。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)

CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
物质
| H2
| CO
| CH3OH
|
浓度/(mol·L-1)
| 0.2
| 0.1
| 0.4
|
①比较此时正、逆反应速率的大小:
v正
?v逆(填“>”、“<”或“=”)。
②若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率
v(CH3OH) =
?mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是
?。


 CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同) CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下: