微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各变化中属于原电池反应的是?(?)
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁皮表面有划损时,仍然能阻止铁被氧化
C.红热的铁丝与水接触,表面形成蓝黑色保护层
D.纯锌与稀硫酸反应时,有大量气泡产生
参考答案:B
本题解析:属于原电池反应要符合原电池的形成条件;活性不同的两电极,电解质溶液,闭合电路。故B符合。Zn-Fe原电池,Zn为负极,保护Fe。
本题难度:一般
2、填空题 氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知:

①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K .(填“增大”、“减小’’或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。
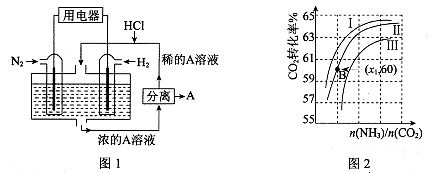
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比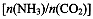 、水碳比
、水碳比 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
参考答案:(13分)
(1)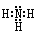 (2分)
(2分)
(2)①N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol
②增大
(3)N2+8H++6e-=2NH4+ (2分) NH4Cl (2分)
(4)Ⅲ (1分); 3 (2分)
本题解析:
(1)氨的分子中氮与氢原子之间形成一对共用电子对,所以氨的电子式是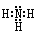
(2)①根据反应的△H=反应物的总键能-生成物的总键能,计算合成氨的△H=946kJ/mol+3×436kJ/mol-3×391×2kJ/mol=-92kJ/mol,所以合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol;
②该反应放热,所以降温,平衡正向移动,生成物浓度增大,反应物浓度减小,化学平衡常数将增大;
(3)该电池的本质反应是合成氨反应,所以正极是氮气发生还原反应,电极反应式为N2+8H++6e-=2NH4+;生成的铵根离子与氯化氢结合生成氯化铵,所以A是NH4Cl;
(4)氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的,是Ⅲ曲线;B点二氧化碳的转化率是60%,氨气的转化率是40%,设NH3、CO2的起始物质的量分别为n1、n2,则n1×40%/2= n2×60%,解得n1/n2= x1=3。
本题难度:一般
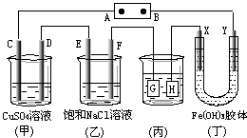
3、选择题 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1:2:2:2
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷