微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列电离方程式中,正确的是
A.Al2(SO4)3=2Al+3+3SO4-2
B.CuCl2=Cu2++2Cl-
C.K2SO4=2K++S6++4O2-
D.Na2CO3=Na++CO
参考答案:B
本题解析:分析:A、硫酸铝是强电解质溶液中完全电离生成离子,标注离子所带电荷错误;
B、氯化铜是溶于水的强电解质完全电离生成铜离子和氯离子;
C、硫酸钾溶液中电离生成硫酸根离子和钾离子;
D、碳酸钠溶液中电离生成钠离子和碳酸根离子,注意电荷守恒.
解答:A、硫酸铝是强电解质溶液中完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,故A错误;
B、氯化铜是溶于水的强电解质完全电离生成铜离子和氯离子,电离方程式为:CuCl2=Cu2++2Cl-,故B正确;
C、硫酸钾溶液中电离生成硫酸根离子和钾离子,电离方程式为:K2SO4=2K++SO42-,故C错误;
D、碳酸钠溶液中电离生成钠离子和碳酸根离子,电离方程式为:Na2CO3=2Na++CO32-,故D错误;
故选B.
点评:本题考查了电离方程式的正误判断和书写方法,注意物质溶解性分析,离子符号书写,电离生成离子的判断,题目较简单.
本题难度:困难
2、选择题 部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HCN
| H2CO3
|
电离平衡常数
(25℃)
| Ki=1.77×10-4
| Ki=4.9×10-10
| Ki1=4.3×10-7
Ki2=5.6×10-11
|
下列选项错误的是
A.HCN+CO32- =CN-+ HCO3-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
参考答案:D
本题解析:A.由于HCN的电离平衡常数K=4.9×10-10大于H2CO3的二级电离平衡常数Ki2 =5.6×10-11而小于一级电离平衡常数Ki1=4.3×10-7,所以酸性:H2CO3> HCN > HCO3-;因此向Na2CO3的溶液中加入HCN,会发生反应:HCN+CO32- =CN-+ HCO3-,正确;B.由于HCOOH的电离平衡常数Ki=1.77×10-4>H2CO3的一级电离平衡常数Ki1=4.3×10-7;所以会发生反应:2HCOOH+CO32- = 2HCOO-+H2O+CO2↑;正确;C.由于甲酸、HCN都是弱酸,因为电离平衡常数HCOOH>HCN,所以当二者的体积相等、pH相等时,物质的量n(HCN)>n(HCOOH),中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,正确;D.在等体积、等浓度的HCOONa和NaCN溶液中,阴离子都发生水解反应而消耗,由于酸性HCOOH>HCN,所以溶液中c(HCOO-)>c(CN-);水解使溶液显碱性,水解程度越大,溶液的碱性就越强,因此溶液中的c(H+)前者大于后者,所含离子总数前者大于后者,错误。
考点:考查弱酸的电离平衡常数的应用及溶液中离子浓度的大小比较的知识。
本题难度:一般
3、选择题 将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是:( )
A.c(NH4+)>c(Cl
 CH3COOH+OH-;加水稀释时平衡正向移动,水解程度增大,前后的
CH3COOH+OH-;加水稀释时平衡正向移动,水解程度增大,前后的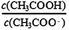 后者大于前者,错误。
后者大于前者,错误。