微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)(NH4)2Fe(SO4)2比FeSO4稳定,其标准溶液是定量实验中的常用试剂。
(1) 实验室用(NH4)2Fe(SO4)2固体配制一定浓度的(NH4)2Fe(SO4)2标准溶液。
①配制溶液时,需要使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的?(填字母代号)

②若要配制0.100 mol·L-1的(NH4)2Fe(SO4)2标准溶液250ml,需称取(NH4)2Fe(SO4)2?g
③若在配制过程中,烧杯中的(NH4)2Fe(SO4)2溶液有少量溅出,则所得溶液浓度?;若在定容时,俯视液面,则所得溶液浓度?。(填“偏高”、“偏低”、“无影响”)
(2)能电离出两种阳离子的盐称为复盐,下列物质中属于复盐的有?。
a.KAl(SO4)2?b.KAlO2?c.NH4Al(SO4)2? d.[Ag(NH3)2]NO3
(3)(NH4)2Fe(SO4)2溶液呈酸性,试用离子方程式解释其原因:
?;?。
参考答案:(共12分)
(1) ①ac(2分)?②7.1g(2分)?③偏低;偏高(2分)
(2)ac(2分)
(3) NH4++H2O NH3·H2O+H+;Fe2++2H2O
NH3·H2O+H+;Fe2++2H2O Fe(OH)2+2H+。(4分)
Fe(OH)2+2H+。(4分)
本题解析:略
本题难度:一般
2、实验题 某研究小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在_________中,再加水稀释,这样操作的目的是____________,操作中不需要的仪器有_________(填字母)。
a?.药匙?b.烧杯? ?c.石棉网?d.玻璃棒?e.坩埚
(2)通入足量SO2时C中观察到的现象为______________,
(3)根据以上现象,该小组同学认为SO2与?FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式________________;
②请设计实验方案检验有Fe2+生成________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法______(填“合理”或“不合理”),理由是___________________________。
(4)D装置中倒置漏斗的作用是_________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有_______(填入正确选项前的字母)?。
a.浓H2SO4?b.酸性KMnO4溶液? ?c.碘水?d.NaCl溶液
参考答案:(1)浓盐酸;抑制氯化铁水解;ce
(2)溶液由棕黄色变为浅绿色
(3)①2Fe3+ + SO2 +2H2O=SO42-+4H++2Fe2+;②取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;③不合理;硝酸可以将溶解的SO2氧化为H2SO4,干扰试验
(4)使气体充分吸收,防止溶液倒吸
(5)bc
本题解析:
本题难度:一般
3、选择题 下列实验不能达到预期目的的是
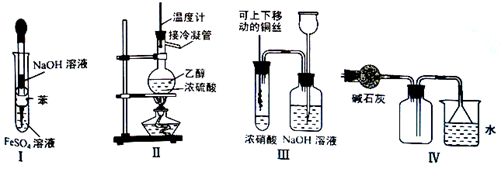
A.利用Ⅰ制取Fe(OH)2
B.利用Ⅱ装置制取C2H4
C.利用Ⅲ装置进行铜与浓硝酸反应的实验
D.利用Ⅳ装置收集NH3
参考答案:B
本题解析:A:可防止Fe(OH)2被空气氧化,正确
B:温度计应插入混合液中,控制混合液温度,不正确
C:可随时控制反应的发生与停止,并且可防止污染空气,正确
D:氨气密度小于空气,应从短管进集气瓶,并且极易溶于水,用倒置的漏斗防止倒吸,正确
本题难度:一般
4、选择题 下列有关实验的说法正确的是
A.现向K2Cr2O7溶液中加入少量氢氧化钠,溶液变为黄色,证明溶液中存在着平衡:Cr2O72-+H2O  2CrO42-+2H+
2CrO42-+2H+
B.CH2=CH-CHO能使酸性高锰酸钾溶液褪色,证明该分子中一定含有碳碳双键
C.用相互滴加的方法不能鉴别NaCl、AlCl3、Na2CO3、NaHSO4四种无色溶液
D.SO2通入Ba(NO3)2溶液中出现白色沉淀,证明BaSO3不溶于水
参考答案:A
本题解析:
正确答案:A,Cr2O72-+H2O  2CrO42-+2H+,加NaOH后,平衡正向移动,由橙色变为黄色;B、碳碳双键和醛基均能使酸性高锰酸钾溶液褪色;C、Na2CO3与NaCl、AlCl3、NaHSO4作用的现象分别是无明显现象、白色沉淀和气泡、气泡;D、不正确,可能生成的是BaSO4,酸性条件下,NO3―能将SO2氧化成SO42―.
2CrO42-+2H+,加NaOH后,平衡正向移动,由橙色变为黄色;B、碳碳双键和醛基均能使酸性高锰酸钾溶液褪色;C、Na2CO3与NaCl、AlCl3、NaHSO4作用的现象分别是无明显现象、白色沉淀和气泡、气泡;D、不正确,可能生成的是BaSO4,酸性条件下,NO3―能将SO2氧化成SO42―.
本题难度:一般
5、实验题 黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
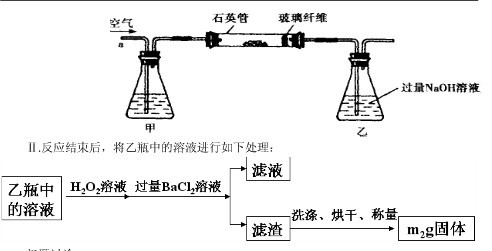
Ⅰ、将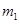 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2?
2Fe2O3+8SO2?
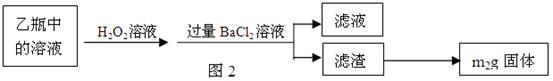
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。
[实验二]测定铁元素的含量。
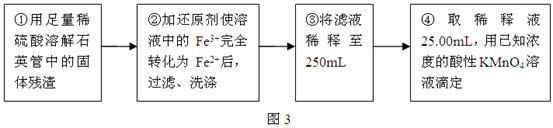
Ⅲ、测定铁元素含量的实验步骤如图3所示:
问题讨论:
 ?
?
(1)Ⅰ中,甲瓶内所盛试剂是?溶液。乙瓶内发生反应的离子方程式有:
?、?。
(2)Ⅱ中的滤渣在称量前还应进行的操作是?。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是?。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有?。
写出④中反应的离子方程式?。
(5)该黄铁矿中硫元素的质量分数为?。
参考答案:(1)NaOH (2分) 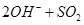 =
=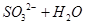 (2分)、
(2分)、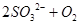 =
=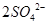 (2分)?(2)洗涤、干燥(2分)?(3)使
(2分)?(2)洗涤、干燥(2分)?(3)使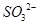 完全转化成
完全转化成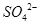 (2分)
(2分)
(4)250ml 容量瓶(2分)? 5Fe2+ + 2MnO4-+16H+==5Fe3++2Mn2++8H2O(2分)?
(5)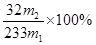 (2分)
(2分)
本题解析:(1)由于空气中含有CO2和水蒸气,所以必须除去,以防止干扰后面的SO2的吸收,因此盛放的是氢氧化钠溶液。SO2是酸性氧化物,能被氢氧化钠溶液吸收,反应的方程式是SO2+2OH-=SO32-+H2O。又因为亚硫酸钠极易被氧气氧化,所以还可能发生反应2SO32-+O2=2SO42-。
(2)沉淀在称量之前还需要洗涤和干燥。
(3)为了使溶液中的SO32-完全被氧化生成SO42-,加入的过氧化钠应该是过量的。
(4)由于要稀释至250ml,所以还需要250ml容量瓶。酸性高锰酸钾溶液具有氧化性,能氧化亚铁离子,反应的方程式是5Fe2+ + 2MnO4-+16H+==5Fe3++2Mn2++8H2O。
(5)硫酸钡的质量是m2g,物质的量是m2/233mol,则SO2的物质的量是m2/233mol,所以硫元素的质量分数是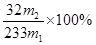 。
。
本题难度:一般