|
高中化学知识点大全《弱电解质电离平衡》考点强化练习(2017年押题版)(二)
2017-08-22 16:15:55
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在醋酸溶液中,CH3COOH的电离达到平衡的标志是
A.溶液显电中性
B.溶液中无醋酸分子
C.氢离子浓度恒定不变
D.溶液中CH3COOH和CH3COO-共存
|
参考答案:C
本题解析:A、醋酸溶液显酸性,错误;B、溶液中若无醋酸分子,说明醋酸完全电离,错误;C、当醋酸的电离达到平衡状态时,溶液中的各离子的浓度保持不变,正确;D、醋酸是弱电解质,弱电解质的溶液中,始终是分子和离子共存的关系,与达到平衡无关,错误,答案选C。
考点:考查电离平衡的判断
本题难度:一般
2、填空题 有浓度为0.1mol?L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+)?依次为a?mol?L-1,b?mol?L-1,c?mol?L-1,其大小顺序为______.
(2)等体积的以上三种酸分别与过量的NaOH?溶液反应,生成的盐的物质的量依次为n?1mol,n2?mol,n3?mol,它们的大小关系为______.
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为______.
(4)与锌反应时产生氢(气)的初始反应速率分别为v1、v2、v3,其大小关系为______.
参考答案:(1)氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以氢离子浓度其大小顺序为a=12b>c,故答案为:a=12b>c;
(2)根据阴离子守恒知,盐的物质的量与酸的物质的量相等,所以生成的盐的物质的量大小关系为n1 =n2=n3,故答案为n1 =n2=n3;?
(3)中和一定量NaOH溶液生成正盐时,酸的浓度相等,如果是一元酸,所用酸的体积相等,如果是二元酸,酸的体积是一元酸的一半,所以三种酸的体积大小关系是V1=2V2=V3,
故答案为:V1=2V2=V3;
(4)与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,三种酸中硫酸中氢离子浓度为0.2mol/L,盐酸中氢离子浓度为0.1mol/L,醋酸中氢离子浓度小于0.1mol/L,所以反应速率大小关系为v2>v1>v3,故答案为:v2>v1>v3.
本题解析:
本题难度:简单
3、简答题 (17分)化学反应原理在科研和生产中有广泛应用。
(1)一定条件下,模拟某矿石形成的反应aW+bQ→cN+dP+eR得到两个图像。

①该反应的△H??0(填“>”、“=”或“<”)。
②某温度下,平衡常数表达式为K =c2(X),则由图(2)判定X代表的物质为____。
(2)将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略 2G(g)。忽略
固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
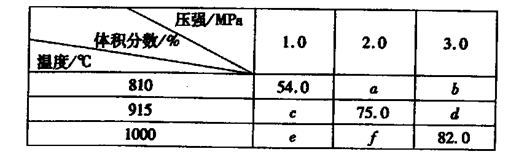
则K(915℃)与K(810℃)的关系为K(915℃)____K(810℃)(填“大于”、“等于”或“小于”),a、b、f三者的大小关系为?,1000℃、3.0 MPa时E的转化率为____。(3)25℃时,H2CO3 ?HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh=?,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O ?HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh=?,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O  ?HCO3-+OH-的事实?。 ?HCO3-+OH-的事实?。
参考答案:(1)①>。②R。(2)大于;f>a>b;69.5%。(3)2.5×10—8,取少量碳酸钠溶液置于试管中,滴加氯化钡溶液有白色沉淀生成,证明含有碳酸根;另取少量碳酸钠溶液置于试管中,滴加酚酞溶液变红,证明有氢氧根生成。
本题解析:(1)①根据图(1)知,该反应的K正随温度的升高而增大,则该反应正向为吸热反应,△H>0。②根据图(2)知,该反应的化学方程式为2W+Q→3N+P+2R;某温度下,平衡常数表达式为K =c2(X),根据平衡常数表达式的书写原则:固体或纯液体不写入平衡常数表达式,则由图(2)判定X代表的物质为R。
(2)反应:E(g)+F(s) 2G(g)正向为气体体积减小的反应,加压,平衡逆向移动,G的体积分数(%)减小,结合题给数据分析,横行为压强对平衡影响的数据,即54.0>a>b;c>75.0>d;e>f>82.0;可得a、b、f三者的大小关系为f>a>b。根据上述分析知,e>c>54.0,表中数据纵行为温度对平衡的影响,升温,G的体积分数(%)增大,平衡正向移动,则该反应正向为吸热反应,则K(915℃)与K(810℃)的关系为K(915℃)大于K(810℃)。根据题给数据知,1000℃、3.0 MPa时G的体积分数(%)为82.0,根据反应:E(g)+F(s) 2G(g)正向为气体体积减小的反应,加压,平衡逆向移动,G的体积分数(%)减小,结合题给数据分析,横行为压强对平衡影响的数据,即54.0>a>b;c>75.0>d;e>f>82.0;可得a、b、f三者的大小关系为f>a>b。根据上述分析知,e>c>54.0,表中数据纵行为温度对平衡的影响,升温,G的体积分数(%)增大,平衡正向移动,则该反应正向为吸热反应,则K(915℃)与K(810℃)的关系为K(915℃)大于K(810℃)。根据题给数据知,1000℃、3.0 MPa时G的体积分数(%)为82.0,根据反应:E(g)+F(s) 2G(g)利用三行式计算,设起始加入的E物质的量为1mol,转化的为x。 2G(g)利用三行式计算,设起始加入的E物质的量为1mol,转化的为x。
E(g)+F(s) 2G(g) 2G(g)
起始(mol):1?足量? 0
转化(mol):x? 2x
平衡(mol):1—x? 2x
则2x/1+x=82.0%,解得x=0.695,E的转化率为69.5%。
(3)25℃时,H2CO3电离常数Ka=c(HCO3—)c(H+)/c(H2CO3),NaHCO3的水解常数Kh=c(H2CO3)c(OH-)/c(HCO3—),则Ka·Kh=Kw,Kh=Kw/Ka=10—14/4×10—7=2.5×10—8,证明Na2CO3溶液中存在
 CO32-+H2O? HCO3-+OH-的事实为取少量碳酸钠溶液置于试管中,滴加氯化钡溶液有白色沉淀生成,证明含有碳酸根;另取少量碳酸钠溶液置于试管中,滴加酚酞溶液变红,证明有氢氧根生成。 CO32-+H2O? HCO3-+OH-的事实为取少量碳酸钠溶液置于试管中,滴加氯化钡溶液有白色沉淀生成,证明含有碳酸根;另取少量碳酸钠溶液置于试管中,滴加酚酞溶液变红,证明有氢氧根生成。
本题难度:一般
4、选择题 在RNH2?H2O?RNH3++OH-的平衡中,要使RNH2?H2O的电离程度及c(OH-)都增大,可采取的措施是( )
A.通入HCl
B.加少量NaOH固体
C.加水
D.升温
参考答案:A.通入HCl时,氯化氢和氢氧根离子反应生成水,所以促进RNH2?H2O的电离程度增大,但c(OH-)浓度减小,故A错误;
B.加入少量NaOH固体,溶液中c(OH-)增大,但抑制RNH2?H2O电离,故B错误;
C.加水稀释促进RNH2?H2O电离,但溶液中c(OH-)浓度减小,故C错误;
D.RNH2?H2O的电离是吸热反应,升高温度促进电离,溶液体积不变,所以氢氧根离子浓度增大,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 类似于水的离子积,难溶盐AmBn也有离子积Ksp,且Ksp=[C(An+)]m·[C(Bm-)]n。已知常温下BASO4的溶解度为2.33×10-4g,则其Ksp为 (? )
A.2.33×10-4
B.1×10-5
C.1×10-10
D.1×10-12
参考答案:C
本题解析:由于BaSO4溶解度较小,其溶液的密度近似于1 g·cm-3,所以,BaSO4溶液中,c(Ba2+)=c(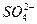 )=1×10-5 mol·L-1,则Ksp=1×10-10。 )=1×10-5 mol·L-1,则Ksp=1×10-10。
本题难度:一般
|