微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某课外兴趣小组为探究某种铝合金(合金元素为Mg、Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计如图所示装置进行实验。
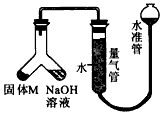
(1)如何检验该装置的气密性____________。
(2)合金样品固体M与氢氧化钠溶液反应的离子方程式______________。
(3)倾斜左边装置使氢氧化钠溶液(足量)与质量为a的合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为V(已折算成标准状况)。若量气管最大量程为50 mL,则固体M中铝的质量[m(Al)]范围为____________。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积__________(填“>” “<”或“=”)V。
(5)若a=38 mg,v=44.8 mL(标准状况),请通过计算说明该合金是否符合国家标准(不写计算过程) ________。(填“符合”或“不符合”)。
参考答案:
(1)安装好装置并在量气管内加入水,向下移动水准管,静置片刻。若水准管中液面与量气管液面维持一定的高度差,说明装置气密性良好
(2)2OH-+2Al+2H2O=2AlO2-+3H2↑
(3)0<m(Al)<0.04g(或m(Al)<0.04g)
(4)>
(5)符合
本题解析:
本题难度:一般
2、填空题 海洋植物如海带、海藻中含有丰富的碘元素,以碘离子的形式存在。实验中从海藻中提取碘的流程如图所示:
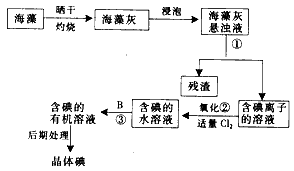
(1)写出提取碘的过程中有关的实验操作名称 ①_________;
写出过程②中有关反应的化学方程式 ____________________________。
(2)提取碘的过程中可供选择的有机试剂为_______。
A.酒精、四氯化碳
B.四氯化碳、苯
C.汽油、醋酸
D.汽油、甘油
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,其中缺少的玻璃仪器是__________。
参考答案:(1)过滤;2NaI+Cl2 =2NaCl+I2
(2)B
(3)漏斗、分液漏斗
本题解析:
本题难度:一般
3、简答题 粗盐中往往含有泥沙和某些其他可溶性盐杂质,实验室取少量粗盐进行提纯.
(1)先将少量粗盐在烧杯中溶解,再过滤得到澄清的滤液(也可能需多次过滤),将滤液倒入蒸发皿中加热,最后得白色的盐晶体.回答下列问题:
1)在上述操作中(不考虑多次过滤),有多次用到玻璃棒,请写出第三次使用玻璃棒的理由______;
2)滤液加热到何种状态就需停止加热?______;
经检验,上述得到的白色晶体中除氯化钠外,还有可溶性的氯化镁、氯化钙、硫酸钠等可溶性盐.
(2)将上述得到的白色晶体溶于水,先加入足量的氯化钡溶液、足量的氢氧化钠溶液,再加入足量的碳酸钠溶液,过滤.在滤液中加入适量和盐酸;加热蒸发,冷却结晶,即得纯净的氯化钠晶体.回答下列问题:
1)加入足量氯化钡溶液的目的是______;
2)氯化钡溶液和碳酸钠溶液加入顺序能否颠倒______(能、不能)?在加入足量氯化钡溶液后再加入足量碳酸钠溶液的理由是______.
参考答案:(1)1)在粗盐提纯中,溶解需要玻璃棒搅拌,加速溶解;过滤得到溶液时,需要玻璃棒来引流,防止液体外溅;蒸发时也需要玻璃棒来搅拌,防止加热时液体飞溅,
故答案为:第三次使用玻璃棒是加热时用玻璃棒搅拌溶液,目的是防止加热时液体飞溅(其他答案也合理);
2)在蒸发操作中,当加热到在较大量晶体析出且还有少量液体时就要停止加热,利用余热将之蒸干,故答案为:加热到在较大量晶体析出且还有少量液体时停止加热,利用余热蒸干;
(2)1)钡离子可以和硫酸根离子反应生成硫酸钡白色沉淀,所以在粗盐提纯时,加入足量氯化钡溶液是为了除去杂质离子硫酸根离子,故答案为:除去食盐中的SO42-;
2)加入足量碳酸钠溶液既可以将粗盐中的钙离子除去又可以将多余的钡离子沉淀,如果氯化钡和碳酸钠的加入顺序颠倒,那样,溶液中混有的多余钡离子无法除去,
故答案为:不能;此时加入足量Na2CO3溶液,既除去原杂质Ca2+,同时除去上步加入的过量Ba2+.
本题解析:
本题难度:一般
4、实验题 下图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。
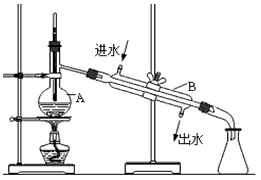
(1)图中的两处明显的错误是 ①__________ ;②___________ 。
(2)A仪器的名称是____________, B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,为防止液体暴沸还需加入少量_______。
参考答案:(1)①温度计的水银球应该在支管口处;②冷凝水的进出方向反了
(2)蒸馏烧瓶 ;冷凝器
(3)沸石
本题解析:
本题难度:一般
5、实验题 黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
【实验一】测定黄铁矿中硫元素的含量
Ⅰ.将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。

|
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)Ⅰ中,石英管中发生的反应方程式为______________________。
(2)Ⅱ中,为判断所加BaCl2是否过量,有同学设计了如下实验方案,其中合理的是________________
A.取少量上层清液,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量。
B.取少量上层清液,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
C.待浊液澄清后,继续滴加BaCl2,若无沉淀产生则说明BaCl2已过量。
D.待浊液澄清后,继续滴加稀H2SO4,若沉淀产生则说明BaCl2已过量。
(3)该黄铁矿中硫元素的质量分数为______________________。
【实验二】测定黄铁矿中铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④取稀释液25.00mL,用浓度为0.10mol/L的酸性KMnO4溶液滴定,实验平均消耗KMnO4溶液体积为V mL。问题讨论
(4)④中,需要用到的主要仪器有______________________;
(5)②中,若选用铁粉作还原剂。你认为合理吗?_______理由是______________________________。
(6)黄铁矿中铁元素的的质量分数为_______________________。
参考答案:(1)4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)C
(3)32m2/233m1
(4)铁架台、酸性滴定管、烧杯、滴定管夹、锥形瓶
(5)不合理;会增加铁元素的量
(6)28V/m1%
本题解析:
本题难度:困难