微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8 +5O2 = 3CO2+ 4H2O。
(1)已知: 2C3H8(g) + 7O2(g) =" 6CO(g)" + 8H2O(l) ?H1
C(s) + O2(g) = CO2 (g) ?H2
2C(s) + O2(g) = 2CO(g) ?H3
则C3H8(g) +5O2((g) = 3CO2(g) + 4H2O(l) ?H= (用?H1、?H2、?H3表示)
(2)写出该电池正极的电极反应式: ,电池工作时CO32-移向 ;用该电池电解1000 mL 1mol/L的AgNO3溶液,此电解池的反应方程式为 ;当电池消耗0.005 mol C3H8时,被电解溶液的pH为 (溶液体积变化忽略不计)。
参考答案:(1)1/2?H1-3/2 ?H3+3?H2
(2)O2+2CO2+4e- 2CO32-;负极;
2CO32-;负极;
4AgNO3+2H2O  4Ag+O2↑+4HNO3 ; 1
4Ag+O2↑+4HNO3 ; 1
本题解析:(1)2C3H8(g) + 7O2(g) =" 6CO(g)" + 8H2O(l) ?H1 ①
C(s) + O2(g) = CO2 (g) ?H2 ②
2C(s) + O2(g) = 2CO(g) ?H3 ③
则由盖斯定律 ①/2+3×②- 3/2×③ 得到C3H8(g) +5O2((g) = 3CO2(g) + 4H2O(l)
?H=1/2?H1-3/2 ?H3+3?H2;
(2)C3H8(g) +5O2((g) = 3CO2(g) + 4H2O(l)正极反应式O2+2CO2+4e- 2CO32-;电池工作时CO32-阴离子移向负极。电解AgNO3溶液的方程式4AgNO3+2H2O
2CO32-;电池工作时CO32-阴离子移向负极。电解AgNO3溶液的方程式4AgNO3+2H2O  4Ag+O2↑+4HNO3;当电池消耗0.005 mol C3H8时,转移的电子的物质的量是0.1 mol,已知4AgNO3+2H2O
4Ag+O2↑+4HNO3;当电池消耗0.005 mol C3H8时,转移的电子的物质的量是0.1 mol,已知4AgNO3+2H2O  4Ag+O2↑+4HNO3中,e-
4Ag+O2↑+4HNO3中,e- H+ ,生成H+的物质的量是0.1 mol,c(H+)=0.1 mol/L, pH=1
H+ ,生成H+的物质的量是0.1 mol,c(H+)=0.1 mol/L, pH=1
考点:盖斯定律和电极反应式的书写
本题难度:一般
2、填空题 (6分)PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ?H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ?H = -566.0 kJ/mol
H2O(g)=H2O(1) ?H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
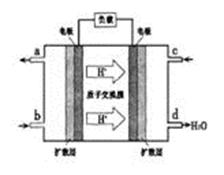
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池正极反应式为__________________。
参考答案:CH3OH(l)+O2(g)==CO(g)+2H2O(l) H="-442.8" kJ/mol C ;O2+4e-+4H+=2H2O
本题解析:
诗题分析:①将三个方程式分别标记为abc,利用盖斯定律,a-b+c×4得2摩尔甲醇不完全燃烧生成一氧化碳和液态水的反应热为-1275.6-(-556.0)+4×(-44.0)="-885.6" kJ/mol。②通过图片信息可知,氢离子向正极移动,所以右侧为燃料电池的正极,氧气在正极反应,故从C口通入,电极反应式为:O2+4e-+4H+=2H2O。
考点:盖斯定律,燃料电池。
本题难度:一般
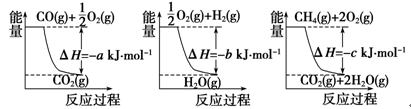
3、填空题 (14分)(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g)  CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式: 。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是________________________________________________。
(4)利用下图装置可以模拟铁的电化学防护。
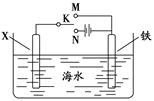
①若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。假设海水中只有NaCl溶质,写出此时总离子反应方程式: 。
②若X为锌,开关K置于M处,该电化学防护法称为 。
写出铁电极处的电极反应式: 。
参考答案:(1)ΔH=(a+3b-c) kJ·mol-1 (2分)
(写成ΔH=+(a+3b-c) kJ·mol-1 或ΔH=-(c-a-3b) kJ·mol-1均正确漏写单位扣1分)
(2)CO(g)+1/2O2(g)=CO2(g) ΔH=-280KJ/mol (2分)
(无状态不得分;CO系数不为1不得分;漏单位扣1分。)
(3)CH4 -8e- + 2H2O = CO2 + 8H+ (2分)
(物质错漏不得分,系数错扣1分)
(4)①N(2分) 2Cl-+2H2O 2OH-+H2↑+Cl2↑ (2分)
2OH-+H2↑+Cl2↑ (2分)
(写成化学方程式不得分;系数、条件和箭头错总扣1分)
②牺牲阳极的阴极保护法 (2分) O2+2H2O+4e—=4OH— (2分)
本题解析:(1)三个反应的热化学方程式为:①CO(g)+1/2O2(g)=CO2(g) ΔH=-aKJ/mol, ②2H2(g)+O2(g)=2H2O(g) ΔH=-bKJ/mol,③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-cKJ/mol,根据盖斯定律分析,三个反应应该①+3×②-③,所以反应热ΔH=(a+3b-c) kJ·mol-1。(2)1克一氧化碳的物质的量为1/28摩尔,所以每摩尔一氧化碳反应生成二氧化碳反应放出的热量为280KJ所以热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-280KJ/mol。(3)甲烷在原电池中左负极,在酸性条件下反应生成二氧化碳和水,电极反应为:CH4 -8e- + 2H2O = CO2 + 8H+。(4)①X为碳棒,减缓铁的腐蚀,需要将铁电解池的阴极,即连接N;电解氯化钠,反应生成氢氧化钠和氢气和氯气,离子方程式为:2Cl-+2H2O 2OH-+H2↑+Cl2↑。②X为锌,开关在M处,则铁做原电池的正极,这种电化学防护法为牺牲阳极的阴极保护法; 铁为原电池的正极,发生吸氧腐蚀,电极反应为:O2+2H2O+4e—=4OH—。
2OH-+H2↑+Cl2↑。②X为锌,开关在M处,则铁做原电池的正极,这种电化学防护法为牺牲阳极的阴极保护法; 铁为原电池的正极,发生吸氧腐蚀,电极反应为:O2+2H2O+4e—=4OH—。
考点:化学反应与能量
本题难度:困难
4、选择题 以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+5/2O2=2CO2(g)+H2O(l);△H=-1300kJ/mol的说法中,正确的是
[? ]
A.有10NA个电子转移时,该反应放出1300kJ的能量
B.有NA个水分子生成且为液体时,吸收1300kJ的能量
C.有2NA个碳氧共用电子对生成时,放出1300kJ的能量
D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
参考答案:AD
本题解析:
本题难度:简单
5、填空题 (1)5.7g汽油(主要成分为C8H18,相对分子质量为114)完全燃烧生成液态水和CO2,放出275.9KJ的热量,则汽油的燃烧热为______
(2)已知:2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol;H2O(l)=H2O(g)△H=+44KJ/mol
a)写出H2与O2反应生成液态水时的热化学方程式______
b)在通常情况下,若要得到857.4KJ的热量,需H2的质量为______,这些H2在标况下的体积为______.
参考答案:(1)5.7g汽油(主要成分为C8H18,相对分子质量为114)物质的量=5.7g114g/mol=0.05mol;完全燃烧生成液态水和CO2,放出275.9KJ的热量,则1mol汽油完全燃烧放热=275.9KJ0.05=5518KJ;依据燃烧热概念计算书写热化学方程式:C8H18(l)+252O2(g)→8CO2(g)+9H2O(l)△H=-5518KJ/mol,
故答案为:C8H18(l)+252O2(g)→8CO2(g)+9H2O(l)△H=-5518KJ/mol;
(2)①2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol;
②H2O(l)=H2O(g)△H=+44KJ/mol
依据盖斯定律①-②×2得到:2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ/mol;
在通常情况下,若要得到857.4KJ的热量,需要氢气物质的量为X则:
2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ/mol;
2?mol?571.6KJ
?Y?857.4KJ
Y=3mol;
需H2的质量=3mol×2g/mol=6g;
这些H2在标况下的体积=3mol×22.4L/mol=67.2L;
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-571.6/mol;6g;67.2L.
本题解析:
本题难度:一般