| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《热化学方程式》试题预测(2017年最新版)(四)
参考答案:(共11分)(1)-285.8(2分) 本题解析:(1)通常条件下,1mol氢气完全燃烧生成液态水放出的热量为氢气的燃烧热。已知反应①2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ·moL-1、②H2O (g)=H2O(l) △H=-44.0KJ·moL-1,则根据盖斯定律可知,①× 本题难度:困难 3、填空题 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
则50s内NO2的平均生成速率为 。 ②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。  写出石墨I电极上发生反应的电极反应式 。 在电解池中生成N2O5的电极反应式为 。 参考答案:(1)4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H ="-905" .0kJ/mol 本题解析:(1)氨气和氧气反应生成一氧化氮和水,由所给热化学方程式 本题难度:困难 4、选择题 白磷与氧可发生如下反应:P4+5O2="==" P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的 |
参考答案:A
本题解析:考查反应热的有关计算。反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据结构简式和方程式可知,该反应的反应热△H=(6a+5d-4c-12b) kJ·mol-1,答案选A。
本题难度:一般
5、选择题 如图所示,△H1=-393.5kJ?mol-1△H2=-395.4kJ?mol-1,下列说法或表示式正确的是( )
A.C(s、石墨)=C(s、金刚石)△H=+1.9kJ?mol-1
B.石墨的能量比金刚石高
C.金刚石的稳定性强于石墨
D.金刚石燃烧的热化学方程式为:C(s、金刚石)+O2(g)=CO2(g)△H=395.4kJ?mol-1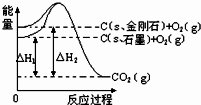
参考答案:A
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《物质的分离、提纯.. | |