微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)0.5mol H2SO4的质量是?g,含?个氧原子,能和?molNaOH完全反应,该硫酸所含氢元素的质量与?mol H3PO4或标准状况下?L HCl中所含氢元素的质量相同。
参考答案:49、2NA 、 1、1/3、22.4
本题解析:m=n×M=0.5mol×96g/mol=49g。1mol硫酸含有4mol氧原子,0.5mol硫酸含有2NA个氧原子。1mol硫酸与2molNaOH反应,0.5mol硫酸与1molNaOH反应。0.5mol硫酸含有1mol氢原子,1mol磷酸含有3mol氢原子,所以1/3mol磷酸含有1mol氢原子。1molHCl含有1mol氢原子,所以HCl标准状况下的体积为22.4L。
点评:本题是物质的量最基础的习题,掌握的是物质的量与微粒个数,质量,气体体积的关系。
本题难度:一般
2、实验题 (10分)某实验需要用1.0mol·L-1 NaOH 溶液450mL。
配制实验操作步骤有:a.在天平来源:91考试网 91ExaM.org上称量?g NaOH固体放入烧杯中,加水溶解,冷却至室温。b.把制得的溶液小心地注入??中。c.继续向容器中加水至距刻度线1cm~2cm处,改用?加水至刻度线。d.用少量水洗涤烧杯和玻璃棒2~3次。e.将瓶塞塞紧,充分摇匀。填写下列空白:
①操作步骤和正确顺序为?。
②该配制过程中两次用到玻璃棒,其作用分别是?、?。
③在进行b步操作时,不慎有液体溅出,下列处理措施正确的是(?)
A.继续进行实验
B.添加部分NaOH溶液
C.倒掉溶液,重新配制
D.倒掉溶液,洗净容量瓶后重新配制
参考答案:(10分)20.0? 500mL的容量瓶?胶头滴管?①abdce ②促进溶解、引流③D
本题解析:考查一定物质的量浓度溶液的配制及有关误差分析。
由于容量瓶的规格没有450ml的,所以应该配制500ml,则需要氢氧化钠的质量是1mo/L×0.5L×40g/mol=20.0g;转移时应该转移至500ml容量瓶中;定容时应该有胶头滴管。
①根据配制的原理及实验要求可知,正确的操作顺序是abdce。
②溶解需要玻璃棒,是为了加速溶解;转移需要玻璃棒,是起引流的作用。
③不慎有液体溅出,则实验已经失败,只能是重新配制,因此正确的答案选D。
本题难度:一般
3、选择题 对于0.1 mol·L-1的Na2SO4溶液的叙述正确的是(? )
A.溶液中含有0.1 mol Na2SO4
B.1 L溶液中含有14.2 g Na2SO4
C.0.1 mol Na2SO4溶于1 L水中
D.将32.2 g Na2SO4·10H2O溶于少量水后再稀释成1 000 mL
参考答案:BD
本题解析:0.1 mol·L-1的含义指1 L溶液中含0.1 mol溶质。0.1 mol Na2SO4即14.2 g。D选项中32.2 g Na2SO4·10H2O中含Na2SO4: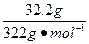 ="0.1" mol,与将14.2 g Na2SO4溶于水,再稀释成1 000 mL结果一样。
="0.1" mol,与将14.2 g Na2SO4溶于水,再稀释成1 000 mL结果一样。
本题难度:简单
4、计算题 (共9分,每小题3分)常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
①该溶液中阴阳离子的总物质的量?②该溶液中CuSO4的物质的量浓度
③取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?(计算过程规范)
参考答案:① 0.100 mol(3分)?② 1.51 mol /·L(3分)?③ 30.2 ml(3分)
本题解析:考查物质的量的有关计算。
①胆矾的摩尔质量是250g/mol
所以根据n=m/M可知,12.5g胆矾的质量是12.5g÷125g/mol=0.05mol
根据胆矾的化学式可知,溶液中铜离子和SO42-的物质的量都是0.05mol/L
所以溶液中阴阳离子总的物质的量是0.05mol×2=0.100mol
②溶液的质量是27.5g+12.5g=40g
溶液的密度是1.21g/ml
所以溶液的体积是40g÷1.21g/ml=33.06ml
因此根据c=n/V可知,溶液的浓度是0.05mol÷0.03306L=1.51mol/L
③由于在稀释过程中溶质是不变的,所以稀释后溶液的体积是
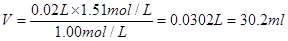
本题难度:一般
5、计算题 (6分)已知:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O一定条件下,将1.92g铜粉溶于50mL物质的量浓度为2mol/L的稀硝酸中,充分反应后铜粉无剩余。求:
(1)能制得标准状况下一氧化氮的体积是多少?
(2)若反应后溶液的体积不变,则溶液中剩余硝酸的物质的量浓度是多少?
参考答案:(6分)V(NO)=" 0.448" L?(3分)?c(HNO3)=略(3分)
本题解析:略
本题难度:一般