|
高中化学知识点归纳《物质的量》试题巩固(2017年最新版)(六)
2017-08-22 16:55:26
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称4gNaOH时误用了“左码右物”方法
|
参考答案:B
本题解析:
试题解析:所用NaOH已经潮解,说明该溶液的溶质NaOH质量偏小,则所配溶液的浓度偏低;故A错误;向容量瓶中加水未到刻度线,说明本溶液中的溶剂是质量偏小,则所配置的溶液的浓度偏高;故B正确;有少量NaOH溶液残留在烧杯里,造成溶质减少,则所配溶液的浓度偏低;故C错误;用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法,将造成溶质的物质的量偏小,故所配溶液的浓度偏低;故D错误.
考点:一定溶质质量分数的溶液的配制;实验数据处理或者误差分析的探究
本题难度:一般
2、选择题 配制物质的量浓度的溶液,造成浓度偏高的操作是( )
A.定容时,滴加蒸馏水超过刻度线
B.定容时,眼睛俯视刻度线
C.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
D.定容时,眼睛仰视刻度线
参考答案:A、定容时,滴加蒸馏水超过刻度线,溶液的体积偏大,浓度偏小,故A错误;
B、定容时,眼睛俯视刻度线,溶液的液面未达到刻度线,溶液的体积偏小,浓度偏大,故B正确;
C、洗涤烧杯和玻璃棒的溶液未转入容量瓶中,洗涤液中含有杂质,溶质的质量偏小,浓度偏小,故C错误;
D、定容时,眼睛仰视刻度线,溶液的液面超过刻度线,溶液的体积偏大,浓度偏小,故D正确;
故选:B.
本题解析:
本题难度:一般
3、计算题 金属及其化合物变化多,用途广。请完成下列计算:
(1)等物质的量的镁在氧气中充分灼烧,产物质量为a g,比它在空气中灼烧所得产物增重b g。它在空气中灼烧后的产物中Mg3N2的质量分数是?(用a、b表示,只考虑空气中氮气、氧气参与反应)。
(2)硬铝(因其主要成分,在此仅看作Al-Cu合金)常用于建筑装潢。1.18g某种硬铝恰好与10mL某浓度的硝酸完全反应,生成的混合气体(其中NO2与NO的体积比为2:1)再与448mL氧气(标准状况)混合,恰好能被水完全吸收。
①计算该硝酸的物质的量浓度。
②计算并确定此种硬铝的化学式。
(3)取5.1g Al-Mg合金与200mL 1mol·L-1的NaOH(aq)充分反应,产生气体a L。过滤,向滤液中通入V L CO2后开始出现沉淀,继续通入CO2使沉淀完全。过滤、洗涤、干燥、灼烧,得到固体5.1 g。则a = ?,V = ?。(气体体积均为标准状况)
(4)向Cu、Cu2O和CuO的混合粉末中加入500mL 0.6 mol·L-1 HNO3(aq),恰好完全溶解,同时收集到1120 mL NO(标准状况)。通过计算推断混合粉末中Cu的物质的量。
参考答案:
(1)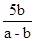 (2分) (2分)
(2)①12.8 mol/L?(3分)
②设硬铝中: Al x mol 、Cu y mol
x=0.02mol,y=" 0.01" mol?所以该硬铝的化学式为Al2Cu 。 (3分)
(3)a= 3.36(2分) 、 V= 1.12?(2分)
(4)0.025<n(Cu)<0.075?(4分)
本题解析:
(1)在氧气中生成氧化镁,在空气中生成氧化镁和假设在相同量1mol的镁分别在氧气和空气燃烧,那么质量相差为1molMgO(40g),1/3 mol Mg3N2(100/3)g,质量相差40g-(100/3)g=20/3 g,要使质量相差b g,则生成Mg3N2的质量为(100/3)*b/(20/3 )g,=5b,而空气中灼烧后的产物质量为a-b,Mg3N2的质量分数是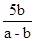 。 。
(2)根据电子的是守恒:金属失去的电子=HNO3得到的电子="NO" NO2混合气体失去的电子=氧气得到的电子 n(O2)=0.448/22.4=0.02mol则转移电子的物质的量n(e-)=0.02*4=0.08mol
设合金中n(Al)="xmol" n(Cu)=ymol则3x+2y=0.08
27x+64y=1.18得到x=0.02? y=0.01? NO2 NO混合气体中
设NO物质的量=a,则NO2物质的量=2a;3a+2a=0.08;a=0.016
n(HNO3)=0.02*3+0.01*2+3*0.016=0.128mol;c(HNO3)=0.128/0.01=12.8mol/L;
合金化学式为Al2Cu
(3)产生气体a L为氢气,2AL-----3H2?灼烧,得到固体5.1 g是氧化铝,其物质的量为0.05mol,根据铝元素守恒可知AlO2-的物质的量为0.1mol,根据关系式2AlO2-? ------可求出CO2的物质的量为0.05mol,故V= 1.12,根据关系式2AL-----3H2?求得氢气物质的量为0.15mol,故a= 3.36
(4)本题为混合物的计算,若建立方程组求解,则解题过程较为繁琐。若抓住反应的始态和终态利用守恒关系进行求解,则可达到化繁为简的目的。
利用氮(N)原子守恒。n(HNO3)= 0.3mol,n(NO)= 0.05mol,则n(Cu(NO3)2)=(0.3-0.05)/2=0.125mol
本题混合物中虽含有Cu、Cu2O和CuO三种物质,但参加氧化还原反应的只有 Cu、Cu2O,所以利用电子守恒可直接求解。转移电子总数:n(e-)= n(NO)×3=0.15mol
设Cu的物质的量为Xmol,Cu则提供电子数:2Xmol
Cu2O提供电子数: 0.15-2Xmol
n(Cu2O)=(0.15-X)/2? mol? n(CuO)= 0.125-X-(0.15-2X)=0.025-X
根据电子守恒进行极端假设:
若电子全由Cu提供则n(Cu)=0.075mol;
若电子全由Cu2O提供则n(Cu2O)=0.075mol,则n(Cu2+)>0.125mol,不可能,但n(CuO)= 0.125-X-(0.15-2X)=-0.025+X>0,解得X>0.025
所以0.025mol < n(Cu)<0.075mol。
本题难度:一般
4、选择题 等质量的下列物质所含分子数最多的是(? )
A.NH3
B.HCl
C.Cl2
D.H2SO4
参考答案:A
本题解析:N=n·NA, n=m/M,.所以等质量的物质若所含分子数最多则摩尔质量最小就符合要求。而摩尔质量在数值上等于相对分子质量。NH3:17, HCl:36.5, Cl2:71, H2SO4:98.故分子数最多的是NH3。选项为 A.
本题难度:简单
5、选择题 下列叙述正确的是( )
A.1 mol氧的质量为16g
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
|