微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 碘及其化合物在生产、生活中具有广泛的用途。解答下列与碘元素有关的试题:
(1)碘是人体中的微量元素之一,是一种智力元素。国家推广“加碘食盐”,其中一般加入的是KIO3,而不是KI。其原因是?。
(2)常温下,NH4I是一种固体,一定温度下在密闭容器中发生下面的反应:
① NH4I(s) 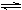 ?NH3(g)? + HI(g)
?NH3(g)? + HI(g)
② 2HI(g) 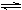 ?H2(g) + I2(g)
?H2(g) + I2(g)
达到平衡时,缩小容器体积,增大体系压强,混合气体的颜色?(填“加深”或“变浅”或“不变”);达到平衡时,反应②的化学平衡常数表达式为?;达到平衡时c(H2)=0.5mol/L,反应①的化学平衡常数为20,则 c (HI) = ?。
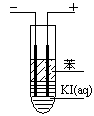
(3)如图,在粗试管中加入饱和的KI溶液,然后再加入苯,插入两根石墨电极,接通直流电源。连接电源负极的电极为?极,电极反应式为?。通电一段时间后,断开电源,振荡试管,上层溶液为?色。
(4)已知Ksp(PbI2)=7.1×10-9mol3/L3。在盛有澄清的PbI2饱和溶液的试管中,滴加浓度为0.1mol/L的碘化钾溶液,振荡,可以观察到溶液中有黄色浑浊产生,这些黄色浑浊的成分是?。
参考答案:
(1)KI在空气中容易被氧气氧化,而KIO3比较稳定 (2分)
(2)加深 (2分) c(H2)·c(I2)/ c2 (HI)? (2分)? 4mol/L (2分)
(3)阴 (1分)? 2H2O + 2e﹣ = 2OH﹣ + H2↑(2分)?紫红色(2分)
(4)PbI2(2分)
本题解析:(1)KI在空气中容易被氧气氧化变质,生成有害物质;而KIO3比较稳定;(2)达到平衡时,缩
小容器体积,增大体系压强,混合气体的颜色肯定是变深的。反应①的平衡常数k=c(NH3)?c(HI);
反应②的平衡常数k=c(H2)·c(I2)/ c2 (HI)?;由反应②可知分解的c(HI)为平衡时c(H2)的
2倍,平衡时c(HI)=xmol?L-1,则氨气的物质的量浓度为:c(NH3)=(x+1)mol?L-1,
代入反应①的平衡常数k=c(NH3)?c(HI)=(x+1)·x=20计算,得到平衡时c(HI)=4mol?L-1。
与电源负极相连的为阴极,阳离子H+放电,? 2H2O + 2e﹣ = 2OH﹣ + H2↑;阳极,阴离子
I-放电:2I- -2e﹣ =I2 ,上层是溶有碘的苯层,显紫红色。(4)Ksp(PbI2)=c(Pb2+)c(I-)2?= 7.1×10-9mol3/L3;c(Pb2+)=1.53×10-3mol/L,c(I-)=2.06×10-3mol/L,滴加浓度为0.1mol/L的碘化钾溶液,振荡,可以观察到溶液中有黄色PbI2浑浊产生。
本题难度:困难
2、选择题 下列能用勒夏特列原理解释的是
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混合气加压后颜色变深
参考答案:AB
本题解析:略
本题难度:一般
3、选择题 (10分)A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.
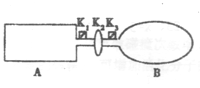
关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g) N2O4(g)△H<0。
N2O4(g)△H<0。
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A)?V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将?(填“变大”、“变小”或“不变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将?。
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将?,B中NO2的转化率将?。
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,?中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率(写出计算过程)
参考答案:(10分)(1)<?变小(2)增大?不变?变小(3)A?(4)40%
本题解析:(1)A容器相当于恒温恒容,B容器相当于恒温恒压;而2NO2(g) N2O4(g)△H<0;随反应的不断进行,A容器内压强逐渐变小,B容器内压强不变易使平衡向正反应方向移动,所以A、B中生成的N2O4的速率是V(A)<V(B);由于A容器内气体压强会不断减小,而B容器内气体压强不变,所以,当打开K3时,气球B会变小。
N2O4(g)△H<0;随反应的不断进行,A容器内压强逐渐变小,B容器内压强不变易使平衡向正反应方向移动,所以A、B中生成的N2O4的速率是V(A)<V(B);由于A容器内气体压强会不断减小,而B容器内气体压强不变,所以,当打开K3时,气球B会变小。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将增大,因加入NO2浓度增大平衡将向正反应方向移动,且由于加入NO2使容器内压强增大,从而使平衡向正反应方向移动,故当达到平衡时,NO2的转化率α(A)将增大;若通入等量的Ne气,则达到平衡时,A中NO2的转化率不变,因为从表面上看,A容器内压强增大了,但容器内各组成的浓度没度,平衡不移动,转化率即也不变;B容器为保持压强不变,体积必然会增大,导致体系内各组分的浓度降低,平衡会向逆反应方向移动,转化率将变小。
(3)B容器的现象可看成是在A容器的基础上降温,平衡将向正反应方向移动,即B容器内NO2气体的浓度将比A容器内NO2气体的浓度低,颜色将更浅。
(4)在相同条件下,体系内压强之比=物质的量之比,4.6g的NO2的物质的量为0.2mol;
2NO2(g) N2O4(g)△H<0
N2O4(g)△H<0
0.2mol? 0
2x? x
0.2mol-2x? x
得:(0.2mol-2x+x)/0.2mol
得:? x=0.04mol
所以NO2的转化率为:(2x0.04mol)/0.2mol=40%
本题难度:一般
4、选择题 将0.6molA和0.5molB充入0.4L密闭容器中发生2A(g)+B(g)?mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2mol.又知5min内用E表示的平均反应速率为0.1mol?L-1?min-1,下列结论正确的是( )
A.A、B的转化率均为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1mol?L-1?min-1
D.平衡时混合物总物质的量为1mol
参考答案:v(D)=0.2mol0.4L5min=0.1mol?L-1?min-1,又知5min内用E表示的平均反应速率为0.1mol?L-1?min-1,
则v(D):c(E)=0.1mol?L-1?min-1:0.1mol?L-1?min-1=1:1,
反应速率之比等于化学计量数之比,则m=1,则
2A(g)+B(g) D(g)+E(g)
D(g)+E(g)
起始:0.6mol 0.5mol 0 0
转化:0.4mol 0.4mol 0.2mol0.2mol
平衡:0.2mol 0.1mol 0.2mol 0.2mol
A.A的转化率为0.4mol0.6mol×100%=33.3%,B的转化率为0.4mol0.5mol×100%=80%,故A错误;
B.由以上计算可知,D、E的反应速率相同,则m=1,故B正确;
C.v(A)=2v(D)=2×0.1mol?L-1?min-1=0.2mol?L-1?min-1,故C错误;
D.平衡时混合物总物质的量为0.2mol+0.1mol+0.2mol+0.2mol=0.7mol,故D错误.
故选B.
本题解析:
本题难度:一般
5、选择题 在一定条件下的定容容器中,当下列物理量不再发生变化时,表明反应A(g)+2B(l) C(g)已达到平衡状态的是?(?)
C(g)已达到平衡状态的是?(?)
A.混合气体的压强
B.混合气体的密度
C.C的物质的量浓度
D.气体的总物质的量
参考答案:BC
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项C正确。根据方程式可知,反应前后体积是不变的,因此气体的总物质的量和压强都是不变的,AD不正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,所以B可以说明。答案选BC。
本题难度:一般