微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将硫磺在氧气中燃烧生成气体A,把气体A溶于水得溶液B,向B中滴加溴水,溴水褪色而B变为C;在C中加入Na2S产生气体D,若将D通入B溶液,可得沉淀E;A、B、C、D、E中均含有硫元素.在下列各组中按A、B、C、D、E排列的是
A.SO2、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、SO2、SO3
C.SO2、H2SO4、H2SO3、SO2、S
D.SO2、H2SO3、H2SO4、H2S、S
参考答案:D
本题解析:分析:将硫磺在氧气中燃烧生成SO2,SO2与水反应生成H2SO3,向H2SO3中滴加溴水,发生氧化还原反应生成H2SO4;在H2SO4中加入Na2S产生气体H2S,若将H2S通入H2SO3溶液,可得沉淀S.
解答:将硫磺在氧气中燃烧生成SO2,SO2与水反应生成H2SO3,
H2SO3具有还原性,与具有氧化性的溴水反应生成H2SO4,
H2SO4的酸性比H2S强,加入Na2S可生成H2S,
H2S具有还原性,H2SO3具有氧化性,二者发生氧化还原反应生成单质S,
故选D.
点评:本题考查含硫物质的性质及综合应用,题目难度不大,注意含硫物质的化学性质,H2SO3与H2S的反应为H2SO3在中学阶段唯一表现氧化性的反应.
本题难度:简单
2、选择题 将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是
A.硫酸
B.碘水
C.硝酸锌
D.氯化铜
参考答案:C
本题解析:Fe溶于过量盐酸生成Fe2+,再加入Zn(NO3)2,在酸性条件下相当于加入了强氧化性的硝酸,则Fe2+被氧化成了Fe3+,而碘、较稀的硫酸和铜离子的氧化性均比Fe3+弱,不能氧化Fe2+。
本题难度:一般
3、选择题 下列转变过程属于氮的固定的是
A.氨气和HCl气体混合生成NH4Cl固体
B.氨的催化氧化
C.工业上用N2和H2 合成氨
D.NO遇到空气变为红棕色
参考答案:C
本题解析:试题分析:游离态的N转化为化合态的N的过程,是氮的固定,所以选项C正确,答案选C。
考点:考查氮的固定的判断
点评:该题是基础性试题的考查,难度不大。该题的关键是记住氮的固定原理,属于常识性知识的巩固与训练,学生不难得分。
本题难度:一般
4、选择题 将足量的铜与一定体积?10mol?L-1的浓硝酸充分反应,得到Cu(NO3)2溶液和NO2、NO混合气体,将集满混合气体的容器倒扣在水中,通入2.24L?O2(标准状况)后,所有气体完全被水吸收生成硝酸.发生反应为:4NO2+O2+2H2O=4HNO3;4NO+3O2+2H2O=4HNO3.若向所得Cu(NO3)2溶液中加入5mol?L-1NaOH溶液使Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.40?mL
B.60?mL
C.80?mL
D.100?mL
参考答案:C
本题解析:分析:整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了,根据电子得失守恒,求出参加反应的铜,然后求出 Cu(NO3)2,再根据 Cu(NO3)2与NaOH 反应的关系,求出NaOH的物质的量,进而计算NaOH溶液的体积.
解答:完全生成HNO3,则整个过程中HNO3 反应前后没有变化,即Cu失去的电子都被O2得到了,
根据得失电子守恒:n(Cu)×2=n(O2)×4,即n(Cu)×2=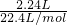 mol×4,
mol×4,
解得n(Cu)=0.2mol,所以Cu(NO3)2 =0.2mol,则:
?Cu2+~2OH-
? ?1? ?2
?0.2mol? n(OH-)
所以n(OH-)=0.2mol×2=0.4mol
需要NaOH溶液的体积为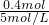 =0.08L=80mL,
=0.08L=80mL,
故选C.
点评:本题考查混合物计算、氧化还原反应计算等,难度较大,利用常规方无法解答,是守恒思想在混合计算典型利用,判断金属失去的电子等于氧气获得的电子是关键.
本题难度:简单
5、选择题 下列物质能用相应单质直接化合而制取的是
A.FeS
B.FeCl2
C.SO3
D.NO2
参考答案:A
本题解析:氯气和铁生成氯化铁,硫和氧气生成SO2,氮气和氧气生成NO,所以答案选A。
本题难度:简单