微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100mL?0.3 mol?L稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560mL;再加入0.2 mol?L-1?NaOH溶液至沉淀质量恰好不再变化,用去350mL?NaOH溶液.则所取样品中铝的物质的量为
A.0.005?mol
B.0.01?mol
C.0.025?mol
D.0.03?mol
参考答案:B
本题解析:分析:镁铝合金与硫酸反应生成硫酸镁、硫酸铝与氢气,向反应后的溶液中加入0.2 mol?L-1?NaOH溶液至沉淀质量恰好不再变化,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为Na2SO4、NaAlO2,根据硫酸根守恒有n(Na2SO4)=n(H2SO4),根据钠离子守恒有n(NaOH)=2n(Na2SO4)+n(NaAlO2),据此计算n(NaAlO2),再根据铝原子守恒n(Al)=n(NaAlO2).
解答:镁铝合金与硫酸反应生成硫酸镁、硫酸铝与氢气,向反应后的溶液中加入0.2 mol?L-1?NaOH溶液至沉淀质量恰好不再变化,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为Na2SO4、NaAlO2,根据硫酸根守恒有n(Na2SO4)=n(H2SO4)=0.1L×0.3mol/L=0.03mol,
根据钠离子守恒有n(NaOH)=2n(Na2SO4)+n(NaAlO2),故n(NaAlO2)=0.35L×0.2mol/L-0.03mol×2=0.01mol,根据铝原子守恒n(Al)=n(NaAlO2)=0.01mol,
故选B.
点评:本题考查混合物的有关计算,难度中等,清楚发生的反应,利用守恒进行计算是解题关键.
本题难度:简单
2、选择题 镁、铝和锌的混合物与足量的盐酸反应生成氢气2.8 L,则三种金属的总物质的量可能为
A.0.250 mol
B.0.125 mol
C.0.100mol
D.0.080 mol
参考答案:C
本题解析:由极限法分析:若为纯金属其消耗量分别为镁0.125 mol,铝约为0.083 4 mol,锌0.125 mol,混合在一起则其总的物质的量应介于0.083 4 mol和0.125 mol之间,故答案为C。
本题难度:一般
3、选择题 将2a?L Al2(SO4)3和(NH4)2SO4的混合物溶液分为两等份,其中一份加入b?mol BaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c?mol NH3气,则原混合溶液中的Al3+离子浓度(mol/L)为
A.
B.
C.
D.
参考答案:C
本题解析:分析:根据SO42-+Ba2+═BaSO4↓计算溶液中的SO42-离子的物质的量,根据NH4++OH- NH3↑+H2O计算NH4+的物质的量,再根据c=
NH3↑+H2O计算NH4+的物质的量,再根据c=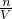 计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
解答:向aL混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,则:
SO42-+Ba2+═BaSO4↓
bmol?bmol
c(SO42-)=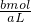 =
=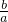 mol/L,
mol/L,
向aL混合溶液中加入足量强碱并加热可得到cmolNH3,则:
NH4++OH- NH3↑+H2O
NH3↑+H2O
cmol? ?cmol
c(NH4+)= =
= mol/L,
mol/L,
又溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+ mol/L×1=
mol/L×1=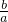 mol/L×2,
mol/L×2,
解得x= mol/L,
mol/L,
故选C.
点评:本题考查混合物的有关计算、根据离子方程的计算、物质的量浓度的计算等,清楚发生的离子反应及溶液不显电性是解答本题的关键,熟悉物质的量浓度的计算公式.
本题难度:简单
4、选择题 将标准状况下的VL?CO2通入含有a?mol氢氧化钠的溶液中经充分反应得溶液I.下列对溶液I中溶质分析正确的是
A.已知V和a的具体数值可以确定溶液I的溶质
B.已知溶液I中溶质的种类和a值,一定能求出V
C.向溶液I中加入足量Ba(OH)2溶液充分反应后,过滤出沉淀,经烘干得固体质量为W克.由W和V的值可确定溶液I的溶质
D.溶液I中含有溶质的组合可能有3种
参考答案:A
本题解析:分析:CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H20,
当n(CO2):n(NaOH)≥1:1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当 <n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
<n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当n(CO2):n(NaOH)≤2,反应按②进行,等于2时,CO2、NaOH恰好反应生成Na2CO3;小于2时,生成Na2CO3,NaOH有剩余,据此讨论结合选项解答.
解答:CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H20,
当n(CO2):n(NaOH)≥1:1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当 <n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
<n(CO2):n(NaOH)<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当n(CO2):n(NaOH)≤2,反应按②进行,等于2时,CO2、NaOH恰好反应生成Na2CO3;小于2时,生成Na2CO3,NaOH有剩余;
A、已知V和a的具体数值,可以确定n(CO2):n(NaOH)比值范围,根据上述分析可以判断溶液I的溶质,故A正确;
B、由上述分析可知,若溶质只有一种,可以根据钠离子守恒计算溶质的物质的量,进而计算CO2的物质的量,计算CO2的体积,若溶液中溶质为混合物,根据钠元素守恒只能列出溶质的物质的量关系,缺少条件,不能计算出a的值,故B错误;
C、向溶液I中加入足量Ba(OH)2溶液充分反应后,所得沉淀为碳酸钡,即W克为碳酸钡的质量,根据W和V的值可确二氧化碳的物质的量,不能确定氢氧化钠的物质的量,不能判断溶液中溶质情况,故C错误;
D、由上述分析可知,溶液I中含有溶质可能有:①NaHCO3,②NaHCO3、Na2CO3,③Na2CO3,④Na2CO3、NaOH,故D错误;
故选A.
点评:本题考查根据反应进行的讨论计算,难度中等,判断CO2与NaOH反应过程是关键,根据二者发生反应结合过量计算分析.
本题难度:困难
5、选择题 将2.7g Al与100mL 2 mol/L H2SO4溶液充分反应后,再慢慢滴入25mL 4mol/LNaOH溶液,其结果是:
A.所得溶液的pH<7
B.溶液中有较多Al(OH)3沉淀
C.取少量所得溶液,加NaHCO3,无明显现象发生
D.另取少量所得溶液,加入几滴浓NaOH溶液,无明显变化
参考答案:A
本题解析:涉及反应(铝为0.1mol、H+为0.4mol、滴入的OH-为0.1mol):
2Al+6H+=2Al3++3H2↑? H++OH-=H2O
0.1? 0.3? 0.1? 0.1? 0.1
可见,铝可消耗0.3mol的H+,剩余的0.1molH+与OH-恰好中和,最终溶液中含有的离子有:Al3+、Na+、SO42-
A:由于Al3+的水解,溶液呈酸性,pH小于7,正确
B:无沉淀
C:Al3++3HCO3-=Al(OH)3↓+3CO2↑,发生又水解反应,有沉淀与气体生成
D:Al3+将与OH—生成白色沉淀,不正确
答案为A
本题难度:简单