微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 水的电离过程为H2O H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低
B.35 ℃时c(H+)>c(OH-)
C.35 ℃时的水比25 ℃时的水电离程度小
D.水的电离是个吸热过程
参考答案:D
本题解析:35 ℃时水的离子积大于25 ℃时水的离子积,说明35 ℃时水中c(H+)、c(OH-)大于25 ℃时水中c(H+)、c(OH-),但c(H+)仍等于c(OH-);亦说明升高温度,水的电离程度增大,即水的电离是吸热过程。
本题难度:一般
2、选择题 已知H2S为弱酸,关于硫化氢水溶液,下列说法不正确的是( )
A.常温下,pH小于7
B.存在关系式:c(H+)=2c(S2-)+c(HS-)+c(OH-)
C.25 ℃时,由水电离产生的c(H+)>1×10-7mol·L-1
D.向溶液中加入少量NaOH固体,c(S2-)增大
参考答案:C
本题解析:H2S为弱酸,所以其水溶液在常温下,pH小于7,A正确;B中符合电荷守恒,正确;H2S是弱酸,抑制水的电离,则25 ℃时,由水电离产生的c(H+)<1×10-7mol/L,C不正确;加入氢氧化钠,消耗氢离子,促进H2S的电离,溶液中c(S2-)增大,D正确,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确外界条件是如何影响弱电解质的电离平衡的,另外还需要灵活运用电荷守恒、物料守恒以及质子守恒等。
本题难度:简单
3、选择题 下列微粒中不能破坏水的电离平衡的是:
A.Na HSO4
B.Al3+
C.CO32-
D.K+
参考答案:D
本题解析:
NaHSO4电离出H+,抑制水的电离平衡;Al3+、CO32-水解,促进水的电离平衡
本题难度:一般
4、选择题 下列关于热化学反应的描述中正确的是
[? ]
A.盐酸和氢氧化钠反应的中和热△H=-57.3kJ·mol-1,则1molH2SO4和足量NaOH在稀溶液中反应的反应热△H=-57.3kJ·m ol-1
B.需要加热才能发生的反应一定是吸热反应
C.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D.CO(g)的燃烧热△H=-283.0kJ·mol-1,则反应2CO2(g)=2CO(g)+O2(g) ;△H=+2×283.0kJ·mol-1
参考答案:D
本题解析:
本题难度:简单
5、选择题 已知常温下CH3COOH的电离平衡常数为Ka。常温下,向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是
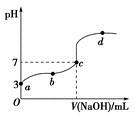
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中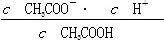 相等
相等
参考答案:C
本题解析:a点表示的溶液中由水电离出的c(H+)等于溶液中的c(OH-),即为1.0×10-11mol/L,A正确。b点溶液呈酸性,即c(H+)>c(OH-),结合电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)可得c(CH3COO-)>c(Na+),B正确。c点溶液呈中性,NaOH的量应不足,故C错误。c(CH3COO-)·c(H+)/c(CH3COOH)表示醋酸的电离平衡常数,温度不变则电离平衡常数不变,故D正确。
本题难度:一般