微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列图示与对应的叙述相符的是
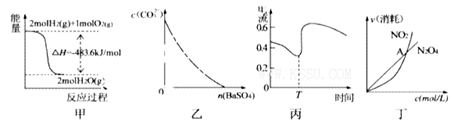
A.图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483. 6kJ
B.图乙表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化
C.图丙表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2
D.图丁表示恒温恒容条件下发生的可逆反应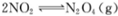 中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
参考答案:C
本题解析:A. 燃烧热是一摩尔的物质着火燃烧产生稳定的氧化物时放出的热量 。H2O的温度的状态为液态,不是气态。因此错误。 B. 在饱和Na2CO3溶液中逐步加BaSO4固体后,会有部分发生沉淀转化BaSO4(s)+CO32-(aq) 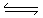 SO42-(aq)+ BaCO3(s).溶液中c(CO32-)的浓度会减小,但最后存在沉淀溶解平衡,浓度不会变为0 。因此错误。C.由于发生原电池反应,使溶液中c(H+)的浓度减小,所以溶液的导电性减弱。在T时加入了H2O2,由于H2O2有强氧化性,能把Zn、Cu氧化为Zn2+、Cu2+,使溶液中的自由移动的离子浓度增大,所以溶液的导电性显著增强。正确。D. NO2、N2O4一种是反应物,一种是生成物,它们的浓度越大,反应速率越快。当交点时只是表示二者的浓度改变与速率改变相等,不等于达到平衡状态。若为平衡状态,应该是同种物质的正、逆发生速率相等,消耗量与增加量相等。错误。
SO42-(aq)+ BaCO3(s).溶液中c(CO32-)的浓度会减小,但最后存在沉淀溶解平衡,浓度不会变为0 。因此错误。C.由于发生原电池反应,使溶液中c(H+)的浓度减小,所以溶液的导电性减弱。在T时加入了H2O2,由于H2O2有强氧化性,能把Zn、Cu氧化为Zn2+、Cu2+,使溶液中的自由移动的离子浓度增大,所以溶液的导电性显著增强。正确。D. NO2、N2O4一种是反应物,一种是生成物,它们的浓度越大,反应速率越快。当交点时只是表示二者的浓度改变与速率改变相等,不等于达到平衡状态。若为平衡状态,应该是同种物质的正、逆发生速率相等,消耗量与增加量相等。错误。
本题难度:一般
2、填空题 研究化学反应原理对于生产生活是很有意义的。
(1)下列关于醋酸的叙述正确的是?(填写符号)。
a.等体积等pH的醋酸和盐酸完全被NaOH溶液中和,消耗NaOH的物质的量一样多
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度比纯水的小
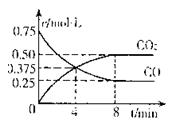
(2)钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:
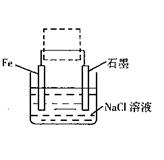
①写出石墨电极的电极反应式?;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改。
③写出修改后石墨电极的电极反应式?。
(3)①高炉炼铁过程中会发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)。
Fe(s)+CO2(g)。
已知:Fe(s)+1/2O2(g)=FeO(s)△H= -272kJ·mol-1
C(s)+O2(g)=CO2(g)?△H= -393.5kJ·mol-1
2C(s)+O2(g)=2CO(g)?△H= -22lkJ·mol-1
则:①FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)
△H=?。
②一定温度下,向某密闭容器中加人足量FeO,
并充人一定量的CO气体,反应过程中CO和CO2的
浓度与时间的关系如图所示则从开始至达到平衡过程中,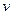 (CO)=?。
(CO)=?。
(4)铁红是一种红色颜料,其成份是Fe2O3。将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为?。
参考答案:(1)bd? (2) ①O2+2H2O+4e-=4OH-?②略?③2Cl-—2e-=Cl2
(3) ① -11Kj/mol?②0.0625mol/(Lmin)? (4)11.2g
本题解析:略
本题难度:一般
3、填空题 已知,在常温常压条件下,氢气的热值为143kJ/g,请写出该条件下H2燃烧的热化学方程式? ▲?。
参考答案:2H2(g)+O2(g)==2H2O(l)△H=-572 kJ·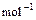 (其他合理答案均对)(2分)
(其他合理答案均对)(2分)
本题解析:略
本题难度:简单
4、选择题 常温下,下列说法不正确的是
A.0.1 mol/L的Na2SO3溶液中粒子浓度关系:c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+)
B.将常温下pH=12的氢氧化钠溶液与pH=2的醋酸溶液等体积混合后,溶液呈碱性
C.把等体积的1×10-5 mol/L的硫酸与4×10-5 mol/L的NaOH溶液相混合,混合液的pH值与5×10-6 mol/L的Ba(OH)2溶液的pH值相同
D.0.2 mol·L-1CH3COOH溶液与0.1 mol·L-1NaOH溶液等体积混合:2c(H+)-2c(OH-) = c(CH3COO-)-c(CH3COOH)
参考答案:B
本题解析:B项:PH为2的盐酸与PH为12的氢氧化钠等体积混合,PH刚刚好为7,为中性,故错。故选B。
点评:本题考查:①混合溶液中离子浓度的关系,②等pH的溶液中物质的量浓度的大小关系③电离和水解的相互关系④酸式盐溶液中离子的浓度大小关系,做题时注意电荷守恒、物料守恒的运用。
本题难度:简单
5、选择题 在25 ℃的条件下,将体积都为10 mL,pH都等于3的醋酸和盐酸,加水稀释到a mL和b mL,测得稀释后溶液的pH均为5,则稀释时加入水的体积( )
A.a=b="10" mL
B.a=b>10 mL
C.a<b
D.a>b
参考答案:D
本题解析:在溶液中,HCl电离是不可逆的,而CH3COOH的电离是可逆的,存在电离平衡,在加水稀释的过程中,HCl溶液里c(H+)的主要变化只有一个,即减小;CH3COOH溶液里c(H+)的主要变化有两个,即减小和增大。若a=b,稀释后的CH3COOH溶液pH<5,若使CH3COOH溶液pH=5,就必须加水稀释,即a>b。
本题难度:一般