微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下体积固定的容器中,可以充分说明可逆反应A(g)+3B(g) 3C(g)+2D(g),达到平衡状态的是
3C(g)+2D(g),达到平衡状态的是
A.混合气的平均相对分子质量不再改变?
B.反应器内A、B、C、D物质的量比为1:3:3:2
C.容器内密度不随时间变化而变化
D.生成 1mol A同时有3 mol C被消耗
参考答案:A
本题解析:A.混合气的平均相对分子质量等于气体的总质量除以总物质的量。根据质量守恒知,气体的总质量一直不变,而总物质的量只有达到平衡才会保持不变,所以混合气的平均相对分子质量不再改变能说明反应达到平衡状态。B,平衡时A、B、C、D物质的量之比不一定等于系数比,B错。C.气体的总质量一直保持不变,容器的容积也保持不变,所以容器内密度一直保持不变,C错。D.反应的任意时刻,生成 1mol A同时都会有3 mol C被消耗,D错。故选A
本题难度:一般
2、填空题 在一定条件下,反应3A(g) + B  ?2C +2D达到平衡
?2C +2D达到平衡
(1)若升高温度,平衡向正反应方向移动,则逆反应是___________(填“吸热”或“放热”)反应,逆反应速率____________(填“增大”或“不变”或“变小”)
(2)若增加或减少B时,平衡不移动,则B是__________态。
(3)若增大压强,平衡向逆反应方向移动,则可判断:B是___态,C是___态,D是__态
参考答案:(1)放热?增大?(2)非气?(3)非气?气?气
本题解析:略
本题难度:简单
3、选择题 有关合成氨工业的说法中,正确的是:?
A.从合成塔出来的混合气体中NH3只占15%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2、H2是循环使用,所以总体来说氨的生产率很高
C.合成氨的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2~5MPa,因在该压强下铁触媒的活性最大
参考答案:B
本题解析:略
本题难度:简单
4、选择题 可逆反应CO(g) + H2O(g) 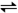 CO2(g) + H2(g),在密闭容器达到平衡。当温度为749K时,K= 1,当CO的起始浓度为2 mol·L-1,H2O的起始浓度为6mol·L-1时,则CO的转化率为
CO2(g) + H2(g),在密闭容器达到平衡。当温度为749K时,K= 1,当CO的起始浓度为2 mol·L-1,H2O的起始浓度为6mol·L-1时,则CO的转化率为
A.80%
B.75%
C.50%
D.25%
参考答案:B
本题解析:
设反应的CO的浓度为ymol·L-1,
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始 (mol·L-1)? 2? 6? 0? 0
反应 (mol·L-1)? y? y? y? y
平衡?(mol·L-1)? 2-y? 6-y? y? y
K="y×y/" (2-y)× (6-y) =1,解得 y=1.5
所以CO的转化率为1.5mol·L-1/2mol·L-1×100%=75%,
故选B.
本题难度:一般
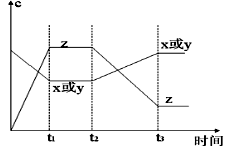
5、选择题 今有X(g)+Y(g) 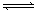 2Z(g)?△H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的(?)
2Z(g)?△H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,据右图回答:从t2→t3的曲线变化是由哪种条件引起的(?)
A.增大X或Y的浓度
B.增大压强
C.增大Z的浓度
D.升高温度
参考答案:D
本题解析:根据图像可知,从t2→t3的曲线变化是反应物的浓度逐渐增大,而生成物的浓度逐渐减小,这说明平衡向逆反应方向进行。由于反应前后体积不变,所以改变压强平衡不移动。正反应是放热反应,所以改变的条件是升高温度,平衡向逆反应方向移动,答案选D。
本题难度:一般