微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是
A.化学反应的实质是旧键的断裂,新键的形成
B.石墨转化为金刚石的反应是吸热反应,说明金刚石比石墨稳定
C.原电池反应的实质是自发进行的氧化还原反应
D.元素周期律的实质是元素原子核外电子排布呈周期性变化
参考答案:B
本题解析:石墨转化为金刚石的反应是吸热反应,这说明石墨的总能量低于金刚石的总能量,所以石墨比金刚石稳定,选项B不正确,其余选项都是正确的,答案选B。
点评:该题是基础性知识的考查,考查的知识点比较分散,但都很基础。有利于巩固学生的基础知识,提高学生灵活运用基础知识解决实际问题的能力,也有利于调动学生的学习兴趣,激发学生的求知欲。
本题难度:一般
2、填空题 氰酸(化学式:HOCN)是一种有挥发性和腐蚀性的液体,在水中立刻发生如下反应形成盐X(俗名碳铵):HOCN + 2H2O → X。
(1). 在上述反应所涉及的各元素中,半径最大的元素原子在周期表中的位置是___________,该原子核外电子共占据_______个轨道。
(2). X所含阳离子的电子式是________;已知25℃时0.1mol/L X溶液pH =7.8,用离子方程式表示原因:______________________。
(3). 能说明氮元素的非金属性比碳元素强的事实是_________(选填编号)。
a. 共用电子对偏向:H-N>H-C? b. 氧化性:NO2>CO2
c. 酸性:HNO3>H2CO3? d. 沸点:NH3>CH4
(4). 据测定,氰酸有两种结构,一种分子内含有叁键,称为正氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出正氰酸和异氰酸的结构式:_______________、______________。
参考答案:.(1)第二周期ⅣA? 4? (2)? NH4+?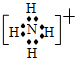 ?HCO3- +H2O
?HCO3- +H2O ? H2CO3+ OH-
? H2CO3+ OH-
(3) a c? (4)H-O-C≡N? (2分) ,? O=C=N-H? (2分)
本题解析:(1)HOCN + 2H2O → NH4HCO3;即C原子的半径最大,核外电子占据了1s2s2px2py四个轨道;
(2)NH4HCO3溶液呈碱性,主要是HCO3-水解呈碱性而导致。
(3)判断非金属性强弱:其单质与氢气结合的难易以及氢化物的稳定性;最高价含氧酸的酸性强弱;单质之间的互相置换等。本题的a选项可看出N元素吸引电子的能力强于C。故选ac。
(4)依据各原子达到饱和所需化学键的个数即可写出
本题难度:一般
3、选择题 某元素X的气态氢化物的分子式为HX,则X的最高正价含氧酸的分子式为
A.H2XO3
B.H2XO4
C.HXO3
D.HXO4
参考答案:D
本题解析:HX中为负一价,正价为+7,D 正确。
本题难度:一般
4、选择题 下列叙述正确的是(?)
A.两种粒子,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子,若核外电子排布相同,则一定属于同种元素
D.不存在两种质子数和电子数均相同的阳离子和阴离子
参考答案:CD
本题解析:A中的粒子,可以是原子、阳离子和阴离子,如Na+和O2-,都是2、8的电子层结构,但化学性质相差甚远。B中当H原子形成H+时, 不与任何稀有气体的原子结构相同。C对于中性原子,其质子数=电子数,所以核外电子排布相同时,一定属于同种元素。判断“不可能存在”“一定”等类结论的 正误时,一般可用反例法,即只要举出一个可以成立的反例来,则可否定题中结论;如果不存在反例,则可认为题中结论正确。
本题难度:一般
5、判断题 (15分)有短周期A、B、C、D、E五种元素,它们的原子序数由A至E渐大。D的氢化物的分子式为H2D,D的最高价氧化物中D的质量分数为40%,且D原子的原子核中质子数和中子数相等。A原子最外电子层上有4个电子。B的阴离子与C的阳离子和氖原子的电子层结构相同。E原子的M电子层上共有7个电子。常温常压下,B单质是气体,已知0.1mol的B单质与1.204×1023个H2完全反应。C单质在加热条件下与B单质反应生成淡黄色固体。根据上述情况,试回答下列各问题。
(1)A~E的元素符号分别为______、______、______、______、______。
(2)C单质和B单质在加热条件下生成化合物A2B2,写出反应的化学方程式:
_______________________________________;
写出A2B2与A的氧化物反应的化学方程式:
_______________________________________。
(3)试写出D、E最高价氧化物水化物分子式_________,_________,并比较酸性强弱________________;写出D、E气态氢化物分子式___________、___________,比较它们的稳定性________________。
参考答案:(1) C、O、Na、S、Cl (5分)
(2)2Na+O2Na2O2(2分)? 2Na2O2+2CO2===2Na2CO3+O2(2分)
(3)H2SO4,HClO4,HClO4>H2SO4;HCl,H2S,HCl>H2S(6分)
本题解析:(易)D的氢化物分子式为H2D,则D的最高价氧化物分子式为DO3,由其中D的质量分数为40%,可求D的原子量M,M/(M+16×3)=40%,得:M=32。又因为原子核中质子数、中子数相等,D中质子数为32÷2=16,D为硫元素。B的阴离子和氖原子的电子层结构相同,B又是气体。根据已知1.204×1023÷6.02×1023="0.2" mol。B是双原子分子,氢气与B2完全反应2H2+B2=2H2B,可知B为氧元素。C的阳离子与氖原子电子层结构相同,根据核电荷数大小顺序,C是金属钠(Na)。又因为E原子M电子层上共有7个电子,所以E为氯元素。C单质在加热条件下与B单质反应生成淡黄色固体Na2O2,证明了C是Na,B是氧。A原子最外电子层上有4个电子且原子序数最小,应为碳。应试策略:根据物质的特征颜色可以对物质进行快速判断,现将常见的有颜色的物质归纳如下表:
淡黄色固体
S、Na2O2、AgBr、Ag3PO4、AgI、FeS2
浅绿色溶液
Fe2+
红色固体
Cu、Cu2O
蓝色溶液
Cu2+
黑色块状固体
FeS
紫红色溶液
MnO4-
紫黑色固体
KMnO4、I2
棕黄色溶液
Fe3+
红棕色粉末
Fe2O3、红磷
血红色溶液
[Fe(SCN)]2+
黑色粉末,晶体
MnO2、Fe3O4、CuS、C、CuO
橙红色溶液
Br2(水)
红褐色沉淀
Fe(OH)3
蓝色晶体
CuSO4·5H2O
白色沉淀
BaSO4、BaCO3、CaCO3、AgCl
红棕色气体
Br2、NO2
蓝色沉淀
Cu(OH)2
黄绿色气体
Cl2
本题难度:一般