微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (共16分)近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注。据中国化工报报道,美国科学家发现了一种新的可将CO2转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近90倍。由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ: CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H 1=-49.58 kJ?mol-1
CH3OH(g) +H2O(g) △H 1=-49.58 kJ?mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H 2
CO(g)+H2O(g) △H 2
反应Ⅲ: CO(g)+2 H2(g) CH3OH(g) △H 3=-90.77 kJ?mol-1
CH3OH(g) △H 3=-90.77 kJ?mol-1
回答下列问题:
(1)反应Ⅱ的△H 2= ,反应Ⅲ自发进行条件是 (填“较低温”、“较高温”或“任何温度”)。
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如下图所示。

①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是 ;
A.n(H2)=3mol,n(CO2)=1.5mol; 650K
B.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650K
D.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡:
a.用H2表示该反应的速率为 ;
b.该温度下,反应I的平衡常数K= ;
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线:

(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、
Ⅲ),测得了不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示,请回答问题:

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是 (选填编号)。
A.改用高效催化剂
B.升高温度
C.缩小容器体积
D.分离出甲醇
E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”),其原因是 。
参考答案:(共16分)
(1)△H2=+41.19kJ?mol-1(2分)较低温(1分)
(2)①B(2分)
②a.0.135mol?L-1?min-1(2分)
b.200(2分)
c.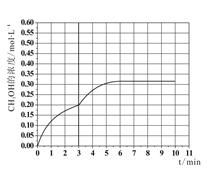
(2分,评分要点:起点不变,终点在0.315左右,10min之前达到平衡)
(3)①CE(2分)②增大(1分),反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇;反应II为吸热反应,温度升高使更多的CO2转化为CO。综上所述,CO的浓度一定增大。(或其他合理答案)(2分)
本题解析:(1)根据盖斯定律,反应Ⅱ=反应Ⅰ-反应Ⅲ,计算反应的△H2=-49.58+90.77=+41.19kJ?mol-1;反应Ⅲ是放热的,熵减的反应,自发进行条件较低温。(2)①因为反应是放热反应,所以选择较低温度,增加氢气的量,可以提高二氧化碳的平衡转化率,所以选B。②a.氢气的平均速率为1.5×60%×3/2/10=0.135mol?L-1?min-1。
b. CO2(g)+3H2(g) CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
起始的物质的量浓度1.5 0.75 0 0
改变的物质的量浓度1.35 0.45 0.45 0.45
平衡的物质的量浓度0.15 0.3 0.45 0.45
c.温度升高,反应速率加快,达到平衡的时间缩短,但温度升高平衡逆向移动,所以平衡时甲醇的浓度在0.315mol/L左右,所以变化如图:
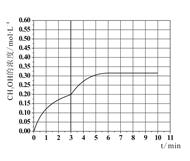
(3)①A.改用高效催化剂,能提高反应速率,但不能提高甲醇的生成量,不选;B.升高温度,反应速率加快,平衡逆向移动,不选;C.缩小容器体积,压强增大,反应速率加快,平衡正向移动,选;D.分离出甲醇,甲醇浓度减小,反应速率减慢,平衡正向移动,不选;E.增加CO2的浓度,反应速率加快,平衡正向移动,提高甲醇的生成量,选;所以选CE。②反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇;反应II为吸热反应,温度升高使更多的CO2转化为CO。综上所述,CO的浓度一定增大。
考点:盖斯定律,化学平衡移动原理,化学平衡计算
本题难度:困难
2、选择题 胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得:101 kPa时,
1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出
890.3 kJ的热量。下列热化学方程式书写正确的是
[? ]
A.CH4(g)+2O2(g)====CO2(g)+2H2O(l);ΔH=+890.3 kJ·mol-1
B.CH4(g)+2O2(g)====CO2(g)+2H2O(l);ΔH=-890.3 kJ·mol-1
C.CH4(g)+2O2(g)====CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1
D.2H2(g)+O2(g) ====2H2O(l);ΔH=-285.8 kJ·mol-1
参考答案:B
本题解析:
本题难度:简单
3、填空题 甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
(1 )甲硅烷中含有的化学键是_________ ,其在固态时属于______ 晶体。
(2 )已知室温下1 g 甲硅烷自燃生成SiO2和水放出热量44.6 kJ ,则其热化学方程式为_________ 。
参考答案:(1 )共价键?分子?
(2 )SiH4(g)+2O2(g)====SiO2(s)+2H2O(l)?ΔH =-1 427.2 kJ/mol
本题解析:
本题难度:一般
4、填空题 (4分)已知25℃、101kpa时,CH3OH(l)的燃烧热为726.5 KJ/mol。
⑴写出该条件下CH3OH(l)完全燃烧的热化学方程式: 。
⑵已知有关反应的能量变化如下图,则反应CH4+H2O(g) CO+3H2的焓变△H=_______。
CO+3H2的焓变△H=_______。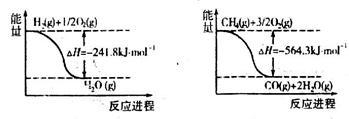
参考答案:(1)CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O(l);△H=" -726.5KJ/mol" (2分)
(2) 161.1 KJ·mol-1(2分)
本题解析:(1)热化学方程,要注意指明反应时的温度和压强,其次,方程中所有的反应物和产物都用括号注明它们在反应时的状态。燃烧,属于放热反应,故△H<0,此热化学方程式为
CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O(l);△H= -726.5KJ/mol。
(2)盖斯定律:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
由图可知H2+(1/2)O2 H2O △H="-24.18KJ/mol" ① CH4+(3/2)O2
H2O △H="-24.18KJ/mol" ① CH4+(3/2)O2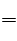 CO+2H2O △H=-564.3KJ/mol②
CO+2H2O △H=-564.3KJ/mol②
既有H2O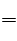 H2+(1/2)O2 △H="24.18KJ/mol" ③
H2+(1/2)O2 △H="24.18KJ/mol" ③
③×3+②
得CH4+H2O(g) CO+3H2 △H=" 161.1" KJ·mol-1
CO+3H2 △H=" 161.1" KJ·mol-1
考点:热化学方程。
点评:此题考核了热力学方程和盖斯定律,要求学生在书写的时候,要注意热力学方程的书写格式。
本题难度:一般
5、填空题 短周期元素A、X、D、E、R、T原子序数依次增大,原子结构及性质如表所示:
元素
| 结构及性质
|
A
| A的原子半径最小
|
X
| X原子最外层电子数是次外层的两倍
|
D
| D是短周期中金属性最强的元素
|
E
| E的最高价氧化物对应水化物是一种常见的两性氢氧化物
|
R
| R与X同主族
|
T
| T的负一价阴离子的核外电子排布与Ar原子相同
|
(1)R元素在周期表的位置是 ,化合物DT中存在的化学键是 。
(2)写出E单质与NaOH溶液反应的离子方程式 。
(3)1g X2A4 完全燃烧,恢复到常温时放出a kJ的热量,写出X2A4完全燃烧的热化学方程式 。
(4)RT4极易水解生成两种酸,写出该反应的化学方程式 。
(5)已知某温度下T的某一元含氧酸的Ka = 4.0×10-8,若一定浓度该酸的pH=4,则此溶液的物质的量浓度为 。
参考答案:(1)第三周期Ⅳ族(1分) 离子键(1分)
(2)2Al+2OH?+2H2O = 2AlO2-+3H2↑ (2分)
(3)C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ?H=" -" 28a kJ?mol-1 (2分)
(4)SiCl4+3H2O =H2SiO3↓4HCl↑ (或SiCl4+4H2O 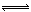 H4SiO4↓+4HCl↑)可以不标“↑”“↓”(2分)
H4SiO4↓+4HCl↑)可以不标“↑”“↓”(2分)
(5)0.25mol?L?1 (2分)
本题解析:A的原子半径最小,则A为H元素;X原子最外层电子数是次外层的两倍,则X为C元素;D是短周期中金属性最强的元素,则D为Na元素;E的最高价氧化物对应水化物是一种常见的两性氢氧化物,则E为Al元素;R与X同主族,则R为Si元素;T的负一价阴离子的核外电子排布与Ar原子相同,则T为Cl元素。
(1)R为Si元素,在元素周期表中位于第三周期Ⅳ族;化合物DT为NaCl,含有离子键。
(2)E为Al,与NaOH溶液反应的离子方程式为:2Al+2OH?+2H2O = 2AlO2-+3H2↑
(3)X2A4 为C2H4,1g C2H4完全燃烧,恢复到常温时放出a kJ的热量,则1mol C2H4即28g完全燃烧,恢复到常温时放出28a kJ的热量,可得热化学方程式:C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ?H=" -" 28a kJ?mol-1
(4)RT4为SiCl4,水解生成的两种酸为H2SiO3和HCl,或H4SiO4和HCl,所以水解方程式为:SiCl4+3H2O =H2SiO3↓4HCl↑ (或SiCl4+4H2O 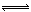 H4SiO4↓+4HCl↑)
H4SiO4↓+4HCl↑)
(5)该酸的pH=4,则该酸电离出的H+浓度为10-4mol?L?1,设该酸的物质的量浓度为C,根据电离平衡常数可得:Ka =10-4×10-4÷(c-10-4)= 4.0×10-8,解得c=0.25mol?L?1
考点:本题考查元素的推断、方程式的书写、化学键的判断、电离平衡常数的计算。
本题难度:困难