微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0 kJ。写出该反应的热化学方程式 。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为 、 mol.
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入甲烷和氧气。通入甲烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应是 (填字母代号)。
a. CH4—e- + 2O2 ="=" CO2 + 2H2O
b. CH4—8e- + 10OH- ="=" CO32- + 7H2O
c. O2 + 2H2O + 4 e- ="=" 4OH-
d. O2—4 e- + 4H+ ="=" 2H2O
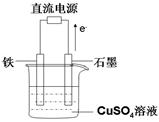
(3)在如图所示实验装置中,石墨棒上的电极反应式为 ;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
2、简答题 能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.
(1)已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.请写出甲醇燃烧的热化学方程式.______
(2)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)?
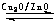
CH3OH(g).甲醇的物质的量与反应温度的关系如图所示:
①合成甲醇反应的△H______0.(填“>”、“<”或“=”)
②其它条件不变,将E点的容积压缩到原来的1/2,正反应速率加快,逆反应速率______.(填“加快”、“减慢”、“不变”),重新平衡时c(CH3OH)/c(CO)______.(填“增大”、“减小”或“不变”)
③230℃时,平衡常数K=1.若其它条件不变,将温度升高到450℃时,达到平衡时,K______1?(填“>、<或=”)
(3)、下列有关甲醇的说法正确的是______
A.甲醇能使蛋白质变性?B.甲醇能发生消去反应
C.甲醇不能被催化氧化?D.甲醇与钠反应比水与钠反应剧烈
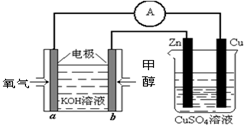
(4)利用甲醇燃料电池设计如图所示的装置:则该装置中Zn极为______极;写出a极的电极反应式______.
3、简答题 由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:______.
若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+
O2(g)═H2O(l)△H=______kJ?mol-1.氢气的燃烧热为______kJ?mol-1.
4、填空题 (1)N2与O2反应生成1gNO?(g),需吸收QkJ的热量,写出其热化学方程式:______
(2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列的3个热化学反应方程式:
Fe203(s)+3CO(g)=2Fe(s)+3C02(g)△H=-Q1kJ/mol
Fe203(s)+
CO(g)=Fe3O4(s)+C02(g)△H=-Q2kJ/mol
Fe304(s)+CO(g)=3FeO(s)+C02(g)△H=+Q3kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:______.
5、填空题 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。
(1)真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJ?mol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJ?mol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H= kJ?mol-1
(用含a、b的代数式表示)。
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g)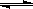 N2(g)+ CO2(g);△H= Q kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g);△H= Q kJ?mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min)
浓度(mol/L)
| 0
| 10
| 20
| 30
| 40
| 50
|
NO
| 1.00
| 0.68
| 0.50 91eXAm.org
| 0.50
| 0.60
| 0.60
|
N2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
|
CO2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
|
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K=
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容绝热条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变