微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质既能跟硫酸反应,又能跟氢氧化钠溶液反应的是
① NaHCO3?② Al2O3?③ Al(OH)3?④ Al
A.①②③④
B.①和③
C.③和④
D.①和④
参考答案:A
本题解析:碳酸氢钠与硫酸生成硫酸钠、水和二氧化碳、与氢氧化钠生成碳酸钠和水;氧化铝和氢氧化铝与硫酸都生成硫酸铝和水、与氢氧化钠都生成偏铝酸钠和水;铝和硫酸生成硫酸铝和氢气、与氢氧化钠溶液生成偏铝酸钠和氢气。
点评:氧化铝和氢氧化铝具有两性。
本题难度:一般
2、选择题 把4.6 g钠放入200 mL 0.1 mol·L-1 AlCl3溶液中,待其充分反应后,下列叙述中错误的是( )
A.Cl-的浓度几乎不变
B.溶液变浑浊
C.溶液中Al3+全部转化为AlO
D.溶液中存在最多的离子是Na+
参考答案:B
本题解析:4.6g钠与水反应生成0.2molOH-,Al3+为0.02mol,所以Al3+全部转变成AlO2-形式存在,因此溶液中无沉淀。答案选B。
点评:本题主要根据碱和铝盐的量来进行判断,比较简单基础。
本题难度:一般
3、选择题 新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,这说明镁合金具有的优异性能是:①熔点低②硬度大③延展性好④导电性强⑤密度小⑥耐腐蚀?
A.①②③
B.②③④
C.①③⑥
D.②⑤⑥?
参考答案:D
本题解析:略
本题难度:简单
4、填空题 烧结法制氧化铝生产过程如下:
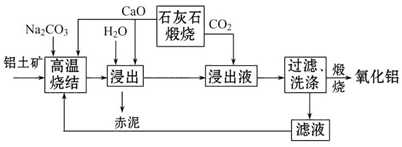
已知:
①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。
②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解的化学方程式____________。
(2)浸出时再加入CaO的目的是______________________________________。
(3)浸出液中发生的生成Al(OH)3的离子方程式为____________________________________。
(4)滤液的主要成分是_________(写化学式);滤液循环使用的优点有________ (任答一点)。
参考答案:(1)Na2Fe2O4+4H2O=2NaOH+2Fe(OH)3↓
(2)除去可能溶于水的硅酸盐,提高氧化铝纯度
(3)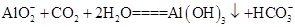
(4)NaHCO3、Ca(HCO3)2?减少工业废水排放或节约原料,降低成本(其他合理答案也可)
本题解析:(1)由题设知,Na2Fe2O4和水是反应物,Fe(OH)3是生成物,则Na2Fe2O4水解反应的化学方程式为:Na2Fe2O4+4H2O=2NaOH+2Fe(OH)3↓。
(2)由于浸出液中可能还含有可溶性硅酸盐,再加入CaO的目的是:除去可能溶于水的硅酸盐,提高氧化铝纯度。
(3)由于浸出液的主要成分是NaAlO2,通入过量CO2气体发生反应的离子方程式为: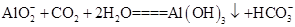 。
。
(4)滤液的主要成分为:NaHCO3和Ca(HCO3)2,滤液循环使用的优点有:①减少工业废水排放;②节约原料,降低成本等。
本题难度:一般
5、选择题 等质量的镁在足量的(1)O2、(2)N2、(3)CO2、(4)空气中燃烧,生成固体物质的质量从大到小顺序正确的是( )
A.(1)(2)(3)(4)
B.(1)(2)(4)(3)
C.(2)(3)(4)(1)
D.(3)(1)(4)(2)
参考答案:D
本题解析:假设Mg有1 mol,在氧气中反应生成MgO增重16 g,在氮气中反应生成Mg3N2,增重28/3g,在CO2中燃烧生成MgO和C增重22 g,在空气中燃烧生成MgO、Mg3N2和C三者的混合物,增重质量介于28/3~22 g,纵观答案所以固体质量从大到小为(3)(1)(4)(2)。
点拨:本题考查物质反应,考查考生对问题的分析能力。难度中等。
本题难度:一般