微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
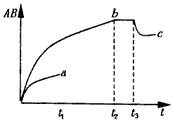
1、选择题 反应A2 + B2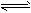 ?2AB;在不同温度和压强改变的条件下,产物AB和AB%的生成情况如图,a为500℃时的情况;b为300℃时的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
?2AB;在不同温度和压强改变的条件下,产物AB和AB%的生成情况如图,a为500℃时的情况;b为300℃时的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是
[? ]
A.A2.B2及AB均为气体,正反应放热
B.AB为气体,A2.B2中有一种为非气体,正反应吸热
C.AB为气体,A2.B2中至少有一种为非气体,正反应放热
D.AB为固体,A2.B2中有一种为非气体,正反应吸热
参考答案:C
本题解析:
本题难度:一般
2、选择题 2SO2(g)+O2(g)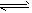 ?2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
?2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
[? ]
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强、反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO2(g)生成的平均速率为 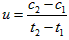
参考答案:D
本题解析:
本题难度:一般
3、填空题 为减少和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。甲醇是一种可再生燃料,它的沸点为64.7℃。有科学家提出绿色构想:把含有CO2的空气或工业尾气通入碳酸钾溶液中,然后再把CO2从溶液中提取出来,经化学反应后得到甲醇,其构想流程如下:(相对原子质量:C-12?O-16?Ca-40?Ba-137)

试回答下列问题:
(1)写出分解池中发生反应的化学方程式_________________________。?
(2)在2×105Pa、300℃合成塔中,若有CO2与H2反应生成32g甲醇和水,放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式: ______________________。?
(3)在合成塔中发生的是放热反应,高温不利于甲醇的生成,合成塔中维持300℃的较高温度的原因可能是_______________;若要提高甲醇的产率,可采取的措施有(写2条):________________?、______________。
(4)甲醇的一个重要作用是制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:_____________________。
(5)常温常压下,饱和CO2水溶液的的pH=5.6,c?(H2CO3)=?1.5×10–5mol/L,若忽略水的电离和H2CO3的二级电离,则H2CO3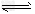 HCO3–+?H+的平衡常数K=?_________?(计算结果保留2位有效数字,己知10–5.6=2.5×10–6)。?
HCO3–+?H+的平衡常数K=?_________?(计算结果保留2位有效数字,己知10–5.6=2.5×10–6)。?
(6)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积常数分别为4.96×10–9、2.58×10–9,该同学应该选用较合适的试剂是_________(填字母)。
A.Ba(OH)2溶液?
B.Ca(OH)2溶液?
C.BaCl2和NaOH混合溶液?
D.CaCl2溶液?
参考答案:(1)2KHCO3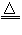 K2CO3+?CO2↑+H2O?
K2CO3+?CO2↑+H2O?
(2)CO2(g)+3H2(g)=?CH3OH?(g)+H2O(g)?ΔH=-49.5kJ/mol
(3)该温度下催化剂的活性最高(较低温时反应速率过慢,生产效率低);降温;加压(或将水和甲醇从混合体系中分离出来;合理即可)
(4)CH3OH+8OH–-6e–=CO32-+6H2O或:2CH3OH+16OH–-12e–=2CO32–+12H2O?
(5)4.2×10–7?mol/L
(6)AD
本题解析:
本题难度:一般
4、填空题 二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题
(1)利用水煤气合成二甲醚的总反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H= -246. 4 kJ/mol
CH3OCH3(g)+CO2(g) △H= -246. 4 kJ/mol
它可以分为两步,反应分别如下
①4H2(g)+2CO(g)=CH3OCH3(g)+H2(g) △H1=-205.1kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=___________
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO的转化率的是__________(填字母代号)。
a.降低温度 b.加入催化剂 c.缩小容器体积 d.增加H2的浓度 e.增加CO的浓
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:
①反应开始时正、逆反应速率的大小:v(正)_____v(逆)(填“>”“<”或 “=”),理由是_______________________
②平衡时n(CH3OCH3)=____________,平衡时CO的转化率=____________
参考答案:(1)-41.3 kJ/mol
(2)cd
(3)①>;反应正向进行,物质的量减小,在同温同压下体积缩小密度增大
②1. 75 mol;75%
本题解析:
本题难度:一般
5、选择题 2SO2(g)+O2(g) ?2SO3(g)△H<0是制备硫酸的重要反应。下列叙述正确的是
?2SO3(g)△H<0是制备硫酸的重要反应。下列叙述正确的是
[? ]
A.选用有效的催化剂能增大正反应速率并提高SO2的转化率
B.增大反应体系的压强、反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为
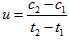
参考答案:BD
本题解析:
本题难度:一般