微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 稀硫酸中加入铜片,无现象,再加入下列某物质后,铜片逐渐溶解,该物质为
A.KNO3
B.NaCl
C.FeCl3
D.Cu(OH)2
参考答案:AC
本题解析:分析:根据铜的化学性质,铜不能与弱氧化性酸反应,但可以和强氧化性酸反应,能与具有氧化性的FeCl3溶液、酸性条件下硝酸盐等反应,据此判断选项.
解答:A、铜与稀HNO3反应,该反应的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,向稀硫酸溶液中加入硝酸钾后,溶液中存在氢离子和硝酸根离子,所以铜能溶解,故A正确;
B、向稀硫酸溶液中加入氯化钠后,溶液中不存在与铜反应的物质,故B错误.
C、向稀硫酸溶液中加入氯化铁后,氯化铁有氧化性,能把铜氧化成铜离子,所以铜能溶解,故C正确.
D、向稀硫酸溶液中加入氢氧化铜后,氢氧化铜是碱能和酸反应生成盐和水,但氢氧化铜和铜不反应,所以铜不溶解,故D错误.
故选AC.
点评:本题考查了铜的化学性质,难度不大,易错选项是A,注意:在酸性环境下,向溶液中加入硝酸盐后,溶液中相当于存在硝酸,所以能和铜反应,只有注意隐含条件的挖掘,才能选出正确选项.
本题难度:一般
2、简答题 (14 分)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s) ="3AlCl(g)+3CO(g)" ?△H="a" kJ·mol-1
3AlCl(g)=2Al(l)+AlC13(g)?△H="b" kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=?kJ·mol-1(用含a、b 的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃) 的化学方程式为?。
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al122+17H2=17MgH2+12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。?
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是?。
②在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为?。
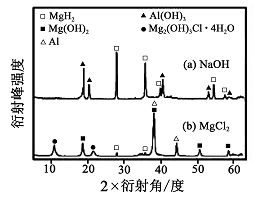
③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中,?图8
混合物Y 均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH 溶液中,混合物Y 中产生氢气的主要物质是?(填化学式)。
(3)铝电池性能优越,Al-AgO 电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 ?。

参考答案:(1)①a+b?②Al4C3+12HCl=4AlCl3+3CH4↑
(2)②防止Mg、Al 被空气氧化?②52 mol?③Al
(3)2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O
本题解析:(1)根据盖斯定律,将题中所给两方程式相加得所求反应,对应的△H=(a+b)kJ·mol-1。含氢量最高的烃为CH4,根据碳原子守恒,3个碳需要结合12个H原子形成3个CH4。再由铝原子守恒,4个铝需要结合12个Cl形成4个AlCl3,所以Al4C3与HCl之间为1:12参加反应。(2)①镁、铝都是活泼的金属单质,容易被空气中的氧气氧化,通入氩气作保护气,以防止二者被氧化。②1mol Mg17Al12完全吸氢 17mol,在盐酸中会全部释放出来。镁铝合金中的镁和铝都能与盐酸反应生成H2,物质的量分别为17mol、18mol,则生成氢气一共52mol。③镁与NaOH不反应,再根据衍射谱图可知,在NaOH溶液中产生氢气的主要物质是铝。(3)铝做负极,失电子被氧化,在碱性溶液中生成NaAlO2。氧化银做正极,得电子被还原为Ag,电解质溶液为NaOH溶液,由此可写出总反应。
【考点定位】盖斯定律,铝及其化合物的性质以及电化学反应方程式
本题难度:一般
3、填空题 (8分)查阅有关资料知:铝与氢氧化钠溶液反应实际是分以下两步进行:
第1步:2Al+6H2O=2Al(OH)3+3H2↑?第2步:Al(OH)3+NaOH=Na[Al(OH)4]
试回答下列问题:
(1)铝与氢氧化钠溶液反应的离子方程式为:?。
(2)判断两步反应的反应类型(用四种基本反应类型作答)
①第1步属?,②第2步属?。
(3)根据你的分析,铝与氢氧化钠溶液反应中氧化剂是?,
还原剂是___________。
(4)若将 Na[Al(OH)4] +4HCl = AlCl3 + NaCl + 4H2O 分两步进行,请写出第1步的化学方程式。
第1步:?
第2步:Al(OH)3 + 3HCl = AlCl3 + 3H2O
参考答案:(1)2Al + 2OH- +6H2O = 2[Al(OH)4]- +3H2↑?(2分)
(2)置换反应(1分)?化合反应(1分) ?(3)H2O(1分)? Al (1分)?
(4)Na[Al(OH)4] + HCl =" NaCl" +Al(OH)3↓+ H2O(2分)
本题解析:(1)①+②*2就会消去Al(OH)3,得到铝与氢氧化钠溶液反应的方程式;
(3)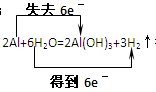 得到铝与氢氧化钠溶液反应中氧化剂是H2O,还原剂为Al;
得到铝与氢氧化钠溶液反应中氧化剂是H2O,还原剂为Al;
(4)总反应方程式减去第二步化学方程式,就会得到第一步化学方程式:Na[Al(OH)4] + HCl =" NaCl" +Al(OH)3↓+ H2O。
本题难度:一般
4、选择题 下列有关铝及其化合物的叙述正确的是? ( )。
A.铝粉与氧化镁共热可制取金属镁
B.足量铝分别与含1 mol HCl、1 mol NaOH的溶液反应,产生相同量的氢气
C.工业上用电解熔融Al2O3的方法冶炼铝
D.在浓硝酸中加入等体积的浓硫酸后,立即加入铝片,铝片表面发生钝化
参考答案:C
本题解析:镁比铝活泼,不能用铝粉制取镁,A错误;根据关系式2Al~6HCl~3H2,2Al~2NaOH~3H2,当铝足量时,等物质的量的HCl和NaOH产生H2的体积比为1∶3,B错误;浓H2SO4溶解于浓HNO3中放出大量热,同时也促进HNO3挥发,使两种酸的浓度减小,铝片不钝化,D错误。
本题难度:一般
5、填空题 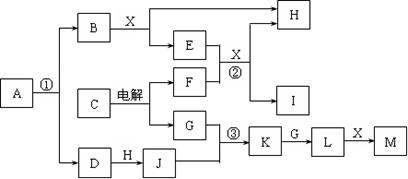 下图所示各物质均由短周期元素组成,部分反应的产物略去。A的摩尔质量为65g/mol,B、F为金属单质,D、H、G为无色气态非金属单质,C、K、L和X都属于氧化物,E、J、M均为重要的化工产品。
下图所示各物质均由短周期元素组成,部分反应的产物略去。A的摩尔质量为65g/mol,B、F为金属单质,D、H、G为无色气态非金属单质,C、K、L和X都属于氧化物,E、J、M均为重要的化工产品。
回答下列问题:
⑴ X的电子式为? ▲?。? ⑵反应②的离子方程式为? ▲?。
⑶反应③的化学方程式为? ▲?。? ⑷A的化学式为? ▲?。
参考答案:⑴ 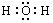 ?⑵ 2Al+2OH-+2H2O=2AlO2-+3H2↑
?⑵ 2Al+2OH-+2H2O=2AlO2-+3H2↑
⑶ 4NH3+5O2 4NO+6H2O? ⑷ NaN3
4NO+6H2O? ⑷ NaN3
本题解析:本题题眼不清楚,要求对于常见物质及其反应非常熟悉。几个方面不可缺少:一是对常见的电解熟知,诸如氯碱工业、铝单质制备;二是对常见化工产品要能列举,诸如氯碱工业制氢氧化钠、工业合成氨、工业制备硝酸等;三是要会分析常见的摩尔质量,诸如CaC2为64g/mol、COS为60g/mol等。本题要能根据各种信息想到NaN3为65g/mol,则一马平川(N3—在平时练习时注意积累,物质结构题经常出现)。
本题难度:一般