微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H20.125mol,原混合物的质量可能是(?)
A.2g
B.4g
C.8g
D.10g
参考答案:BC
本题解析:略
本题难度:简单
2、填空题 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
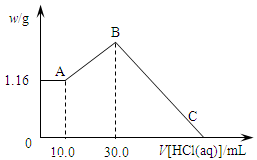
(1)A点的沉淀物的化学式为?。
(2)写出A点至B点发生反应的离子方程式:?。
(3)原混合物中NaOH的质量是?g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为?mL。
参考答案:(1)Mg(OH)2? (2)AlO2-+H++H2O=Al(OH)3↓ (3)5.20? 130.0
本题解析:(1)向所得浊液中,逐滴加入1.00mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:①0~10ml,随盐酸的体积增加,生成沉淀的质量不变,说明氢氧化钠过量,加入的盐酸与氢氧化铝先反应,方程式为NaOH+HCl=NaCl+H2O。因此A点沉淀是Mg(OH)2,其质量是1.16g,物质的量n=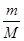 =
=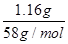 =0.02mol。则根据原子守恒可知原混合物中氯化镁的物质的量=0.02mol。
=0.02mol。则根据原子守恒可知原混合物中氯化镁的物质的量=0.02mol。
(2)NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O。NaOH过量,溶液是NaCl、NaAlO2和NaOH的混合液,则A~B阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓。
(3)A~B阶段消耗盐酸的物质的量=(0.03L-0.01L)×1.0mol/L=0.02mol,则根据方程式NaAlO2+HCl+H2O=Al(OH)3↓+NaCl可知生成氢氧化铝的物质的量=0.02mol。所以根据原子守恒可知原混合物中氯化铝的物质的量是0.02mol。B点沉淀达到最大值,此时的沉淀是氢氧化镁和氢氧化铝的混合物。而溶液则恰好是氯化钠溶液。根据氯离子守恒可知氯化钠的物质的量=0.03L×1.00mol/L+0.02mol×2+0.02mol×3=0.13mol。所以根据钠离子守恒可知,氢氧化钠的物质的量也是0.13mol,因此氢氧化钠的质量m=n· M=40g/mol×0.13mol=5.2g。B~C阶段加入的盐酸开始溶解氢氧化铝和氢氧化镁,此时反应的方程式为Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O。根据氢氧化镁和氢氧化铝均是0.02mol可知,该阶段消耗盐酸的物质的量是0.02mol×2+0.02mol×3=0.10mol,其体积是0.10mol÷1mol/L=0.1L=100ml,所以C点(此时沉淀恰好完全溶解)HCl溶液的体积为30ml+100ml=130ml。
本题难度:一般
3、选择题 两份铝屑,一份与过量HCl反应,另一份与过量NaOH溶液反应,产生的H2体积比为1:2,则两份铝屑的质量比为( )
A.1:2
B.1:1
C.1:3
D.2:1
参考答案:铝屑与过量HCl反应,铝与过量NaOH溶液反应,两份铝产生的H2体积比为1:2,
所以两份铝产生H2的物质的量比为1:2.
根据电子转移守恒,所以两份铝提供的电子的物质的量之比为1:2,
所以两份铝的物质的量之比为1:2.
故选:A.
本题解析:
本题难度:简单
4、填空题 铝及其化合物在生产生活中具有重要的作用。
(1)铝在元素周期表中的位置是?。
(2)已知电负性的数值表示原子对电子吸引能力的相对大小。以下是几种原子的电负性数值:
?
①铝的电负性χ的范围是?。
②电负性的数值与元素金属性的关系是?。
③下列实验能比较镁和铝的金属性强弱的是?。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al(s)+3O2(g)=2Al2O3(s)?ΔH1=-3352 kJ/mol
Mn(s)+O2(g)=MnO2(s)?ΔH2= -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是?。
(4)冶炼金属铝时,用石墨做电极电解熔融Al2O3。液态铝在(填“阴”或“阳”)?极得到,电解过程中,阳极石墨需要不断补充,结合电极反应说明其原因是?。
参考答案:(14分,每空2分)
(1)第3周期第ⅢA族
(2)①电负性数值越大,元素的金属性越弱
② 1.2<χ<1.8
③ c
(3)4Al(s)+ 3MnO2(s)=3Mn(s)+2Al2O3(s)? ΔH=–1789 kJ/mol
(4)阴
在阳极发生反应2O2-– 4e-=O2↑,C+O2=CO2,石墨由于被消耗需要不断补充
本题解析:(1)Al为13号元素,位于第3周期第ⅢA族。
(2)①根据电负性的变化规律,铝的电负性介于Mg和Si之间。
②电负性数值越大,原子对电子吸引能力越大,失电子越难,所以金属性越弱。
③a、导电性与电负性无关,错误;b、等物质的量浓度的Al2(SO4)3和MgSO4溶液,SO42?浓度不同,错误;c、加过量NaOH溶液,AlCl3溶液先出现沉淀后溶解,说明Al(OH)3呈两性,金属性弱于Mg,正确。
(3)首先写出化学方程式,注明状态,然后根据盖斯定律求焓变:?H=?H1–3?H2=" –1789" kJ?mol?1,进而写出热化学方程式。
(4)Al3+在阴极得电子生成Al;阳极O2?得电子生成O2,在较高温度下与石墨反应生成CO2,石墨电池被消耗,所以需要不断补充。
本题难度:困难
5、选择题 现有一块铝铁合金,欲测定其铝的质量分数,切下W g合金,溶于盐酸中,再加入过量NaOH溶液,滤出沉淀,将沉淀在空气中充分灼烧,最后得到W g红棕色粉末。则此合金中铝的质量分数约为( )
A.20%
B.30%
C.70%
D.80%
参考答案:B
本题解析:
正确答案:B
由题意,Al和 Fe最后变成Fe2O3,合金中铝的质量分数,就是Fe2O3中氧的质量分数,48÷160×100%=30%
本题难度:简单