微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 ( 11分)乙醇的沸点是78℃,能与水以任意比混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制醚的反应原理是:
2CH3CH2OH?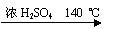 H2O + CH3CH2—O—CH2CH3 (乙醚)
H2O + CH3CH2—O—CH2CH3 (乙醚)
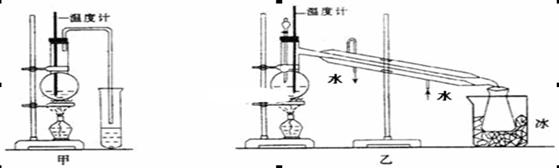
(1)甲图和乙图是两套实验室制乙醚的装置,选装置_______(填“甲”或“乙”)最合理,理由是_____________。
(2)反应液中应加入沸石,其作用是____________。
(3)反应中温度计的正确位置是水银球置于________________________。
(4)用上述装置乙制得的乙醚中可能含有大量的杂质,该杂质是__________,除去这种杂质的简易方法是________________________________。
(5)如果温度太高(如170℃),将会发生一个有机副反应,反应方程式为:____________________________________________。
参考答案:(1)乙(1分),?冷却效果好(乙醚远离火源)(1分)?(2)防止暴沸(1分)
(3)反应物的液面下,但不能触及瓶底(2分)
(4)乙醇 (1分)?将其与饱和 Na2CO3混合,然后静置分液(2分)
(5)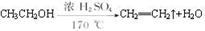 (3分)
(3分)
本题解析:(1)通过题给信息知,乙醚的沸点为34.6℃,易挥发,易燃烧,则制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近,否则会有危险,应选乙装置,原因是冷却效果好,乙醚远离火源;(2)反应液中应加入沸石,其作用是防止暴沸;(3)温度计测量的是混合液的温度,(3)反应中温度计的正确位置是水银球置于反应物液面以下,但不能触及瓶底;(4)由于乙醇的沸点78℃,随着反应温度的提高会有较多的乙醇挥发出来,根据题给信息知,可用用Na2CO3溶液将乙醚与乙醇分离,操作是将其与饱和Na2CO3溶液混合,静置分液;(5)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应方程式为: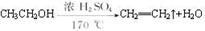 。
。
本题难度:一般
2、选择题 下列关于物质的检验说法不正确的是( )
A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子
B.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后在用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+?存在
D.某溶液中滴入KSCN溶液后呈红色,说明该溶液中有Fe3+
参考答案:A.加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,可能含硫酸根离子或银离子,但二者不能同时存在,故A错误;
B.将铂丝放在稀盐酸中洗涤后灼烧至无色,然后在用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,为避免钠的黄光的影响,则透过蓝色钴玻璃进行观察K的焰色,故B正确;
C.因铵盐与碱反应生成氨气,氨气使湿润的红色石蕊试纸变蓝,则待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+存在,故C正确;
D.铁离子遇KSCN溶液变血红色,则溶液中滴入KSCN溶液后呈红色,说明该溶液中有Fe3+,故D正确;
故选A.
本题解析:
本题难度:简单
3、实验题 (8分)如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放100 mL6 mol/L的盐酸,烧杯乙中盛放100 mL冷水。现向烧杯甲的溶液中放入7.2 g镁条,同时向烧杯乙中放人10 g NH4Cl和20 g氢氧化钡晶体,搅拌使之溶解。
 ?
?
(1)A瓶中气体颜色?,理由是?;
(2) B瓶中气体颜色?,理由是?;?
参考答案:(8分)(1)变深? Mg与盐酸反应放热,所以A中气体温度升高。2NO2 N2O4(正反应为放热反应),平衡向左移动,NO2浓度增大,颜色加深;
N2O4(正反应为放热反应),平衡向左移动,NO2浓度增大,颜色加深;
(2)变浅? NH4Cl与晶体氢氧化钡反应吸热,使B中气体温度降低,上述平衡向右移动,NO2浓度减小,颜色变浅。
本题解析:考查反应与能量的关系、温度对化学平衡的影响
对于可逆反应2NO2(红棕色) N2O4(无色),正反应是放热反应
N2O4(无色),正反应是放热反应
(1)金属与酸的置换反应为放热反应,升温使平衡左移,NO2的浓度增大,红棕色加深
(2)NH4Cl与氢氧化钡晶体在常温下发生吸热反应,降温使可逆反应正向移动,NO2浓度减小,颜色变浅
本题难度:简单
4、实验题 某化学兴趣小组为探究SO2的性质,查阅相关资料知:实验室制取SO2气体的反应原理为Na2SO3 + H2SO4  Na2SO4 + SO2↑+ H2O,据此设计如下图所示装置进行相关实验。
Na2SO4 + SO2↑+ H2O,据此设计如下图所示装置进行相关实验。
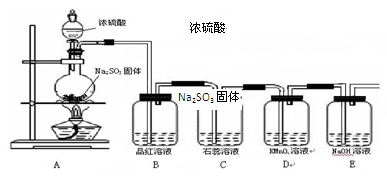
请回答下列问题:
(1)盛装浓硫酸的仪器的名称是?。
(2)按上图连接好装置再? ?(填操作名称),然后加入试剂并加热。
(3)实验过程中, 装置B、C中可观察到的实验现象分别是?、?。
(4)D中可观察到的现象是_______________,说明SO2具有?性。
(5)装置E的作用是?。
参考答案:(1)分液漏斗 (2 分)?(2)检查装置的气密性。(2 分)
(3)品红溶液褪色(1分) 石蕊试液变红(1分)
(4)KMnO4溶液褪色(1分) 还原(1分)
(5)吸收SO2,防止污染环境。(2 分)
本题解析:(1)根据仪器的构造特点可知,盛装浓硫酸的仪器的名称是分液漏斗。
(2)装置连接好以后,必须检查装置的气密性。
(3)A中生成SO2,SO2具有漂白性,且溶于水生成亚硫酸,溶液显酸性,所以装置B、C中可观察到的实验现象分别品红溶液褪色、石蕊试液变红。
(4)SO2还具有还原性,能使酸性高锰酸钾溶液褪色,所以D中可观察到的现象是KMnO4溶液褪色。
(5)SO2是大气污染物,所以装置E的作用是吸收SO2,防止污染环境。2的制备、性质检验、尾气处理以及仪器的识别
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,注重基础知识的巩固与训练,侧重能力的培养。有助于培养学生规范、严谨的实验设计能力,提高学生的综合实验能力,提升学生的学科素养。该类试题重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
5、选择题 某种混合气体可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热CuO,气体体积都没有变化。再通过足量的Na2O2固体,气体体积减小。最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。以下对混合气体组成的判断,正确的是( ?)
A.一定没有N2,CO和HCl中至少有一种
B.一定有N2、HCl和CO
C.一定有N2,CO和HCl中至少有一种
D.一定有N2和HCl,没有CO
参考答案:C
本题解析:将混合气体依次通过NaHCO3溶液和灼热的CuO,气体体积无变化,气体若含有CO、HCl,在此全部转化为CO2.再通过Na2O2,气体体积明显减小,Na2O2一定是吸收了前面生成的二氧化碳气体,且同时生成氧气,使气体体积明显减小;最后通过灼热的铜网,体积又减少,并有剩余气体,说明一定有N2,所有混合气体中一定有N2,可能有HCl、CO中至少含有一种,答案选C。
点评:本题以物质推断的形式考查常见物质的性质,体现学生根据实验现象判断结果的能力和分析解决问题的能力。该题主要是以根据物质之间相互作用时的实验现象方面进行分析、判断,从而得出正确的结论,有利于培养学生的逻辑推理能力。
本题难度:简单