微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据下列实验现象,所得结论错误的是
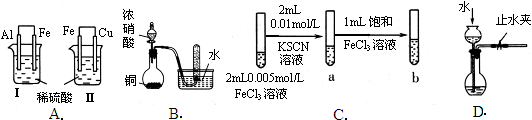
实验
| 实验现象
| 结论
|
A
| Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡
| 活动性:Al>Fe>Cu
|
B
| 试管中收集到无色气体
| 铜与浓硝酸反应产物是NO
|
C
| 试管b比试管a中溶液的红色深
| 增大反应物浓度,平衡向正反应方向移动
|
D
| 长颈漏斗内液面高于烧瓶内液面且保持不变
| 装置气密性良好
|
?
参考答案:B
本题解析:A、根据原电池的工作原理,左烧杯中铁表面有气泡,说明负极为铝,正极为铁,金属活动性Al>Fe,右边烧杯中铜表面有气泡,说明铁为负极,铜为正极,金属活动性Fe>Cu,则活动性为Al>Fe>Cu,故A正确;B、Cu与浓硝酸反应,反应中的化合价变化为:HNO3中N元素由+5价降低为NO2中N元素+4价,HNO3是氧化剂,NO2是还原产物,方程式为:Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O;生成的红棕色二氧化氮和水发生氧化还原反应,3NO2+H2O=2HNO3+NO,所以图中试管中收集到无色气体为一氧化氮,但不是铜和浓硝酸反应生成一氧化氮,故B错误;C、Fe3+遇SCN-发生反应Fe3++3SCN-?Fe(SCN)3,Fe(SCN)3为血红色,增大氯化铁溶液的浓度,根据溶液颜色变化来判断反应方向,如果溶液颜色加深,则说明平衡向正反应方向移动,所以能达到实验目的,故C正确;D、该装置的气密性检查,主要是通过气体压强增大看体积变化来进行检验,夹紧止水夹,向长颈漏斗中加水至其液面高于烧瓶内的液面,一段时间后,看液面高度差有无变化,变化说明装置漏气,反之不漏气,故D正确。
本题难度:一般
2、实验题 某化学小组为测定加碘盐中KIO3的质量分数,进行了如下实验。
已知:KIO3 + 5KI + 3H2SO4= 3K2SO4 + 3I2 + 3H2O
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配制溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量的KI溶液;
步骤三:用bmol·L-1 Na2S2O3溶液的溶液滴定步骤二所得溶液至终点,记录数据;再重复滴定2次,平均消耗Na2S2O3溶液的体积为12.00mL。
(1)步骤一中配制250mL溶液,所用到的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还有?。
(2)步骤三中进行滴定的过程中下列哪个操作正确?,

选择?作为指示剂,到达滴定终点时的现象为?。
(3)实验测得此加碘盐中KIO3的质量分数=?(KIO3的相对分子质量为214)。
参考答案:
(1)250mL容量瓶
(2)B?淀粉?
当滴入最后一或半滴Na2S2O3溶液时,溶液的蓝色褪去,且半分钟内溶液不恢复蓝色。
(3)(4.28b)/a × 100%
本题解析:(1)配制250mL溶液用到的仪器有托盘天平、药匙、玻璃棒、烧杯、250mL容量瓶、量筒(可用可不用),故还需要的玻璃仪器有:250mL容量瓶,故答案为:250mL容量瓶;
(2)硫代硫酸钠显碱性,应使用碱式滴定管,因此选B。硫代硫酸钠遇到碘单质被碘氧化,可以使碘变成碘离子,因此使用淀粉作指示剂。到达滴下终点时的现象为:当滴入最后一或半滴Na2S2O3溶液时,溶液的蓝色褪去,且半分钟内溶液不恢复蓝色。
(3)25mL溶液消耗Na2S2O3的物质的量为b?mol?L-1×0.012L=0.012mol,故250mL溶液应消耗Na2S2O3的物质的量为0.012bmol×10=0.12bmol,令250mL溶液中KIO3的物质的量为xmol,则:
KIO3~~~~3I2~~~~6Na2S2O3
1? 6
xmol?0.12bmol
所以x=0.02b
故加碘盐中KIO3的质量分数: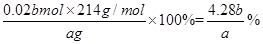
本题难度:一般
3、实验题 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量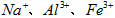 等杂质)生产医药级二水合氯化钙(
等杂质)生产医药级二水合氯化钙(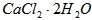 的质量分数为97.0%~103.0%)的主要流程如下
的质量分数为97.0%~103.0%)的主要流程如下

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量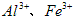 。检验
。检验 是否沉淀完全的试验操作是___________________。
是否沉淀完全的试验操作是___________________。
(2)酸化操作是加入盐酸,调节溶液的约pH为4.0,其目的有:
①将溶液中少量的 转化为
转化为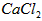 ;
;
②防止 在蒸发时水解;
在蒸发时水解;
③___________________。
(3)测定样品中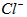 含量的方法是:
含量的方法是:
a.称取0.7500g样品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用0.05000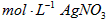 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积的平均值为20.39mL。
溶液体积的平均值为20.39mL。
①上述测定过程中需要溶液润洗的仪器有___________________。
②计算上述样品中 的质量分数为___________________。
的质量分数为___________________。
③若用上述办法测定的样品中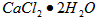 的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。
的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________________;___________________。
参考答案:(1)取少量上层清液,滴加KSCN溶液,若不出现血红色,则表明Fe(OH)3沉淀完全
(2)防止溶液吸收空气中CO2
(3)①酸式滴定管;②99.9%;③样品中存在少量的NaCl;少量的CaCl2·2H2O失水
本题解析:
本题难度:一般
4、选择题 下列实验操作和数据记录都正确的是
A.用托盘天平称量时,将NaOH固体放在右盘内的滤纸上,称得质量为10.2g
B.用50mL酸式滴定管量取KOH溶液,体积为36.60mL
C.用湿润的pH试纸测稀 盐酸溶液的pH,pH=3.52
盐酸溶液的pH,pH=3.52
D.用10mL量筒粗略量取NaCl溶液,体积为9.2mL
参考答案:D
本题解析:略
本题难度:简单
5、选择题 (双选)下列实验方法正确的是
A.用无水乙醇提取碘水中的碘单质
B.加入稀HNO3和BaCl2溶液产生白色沉淀的溶液中一定含SO42-
C.可用FeCl3溶液一次性鉴别CCl4、苯酚溶液、NaI溶液和NaCl溶液
D.玻璃棒在配制0.1mol/L NaCl溶液与粗盐提纯的实验中所起的作用相同
参考答案:CD
本题解析:乙醇与水混溶不分层,不适合作碘水的萃取剂,应选择四氯化碳或苯,故A错误;稀硝酸具有强氧化性,能将亚硫酸根离子氧化为硫酸根离子,且银离子与氯化钡反应生成的白色氯化银沉淀不溶于稀硝酸,因此可溶性银盐溶液、亚硫酸盐溶液、硫酸盐溶液都能产生相同的现象,应先滴入适量盐酸无明显变化,后滴入少量氯化钡溶液产生白色沉淀,说明待测溶液中一定含有硫酸根离子,故B错误;向四种待测溶液中分别加入适量氯化铁溶液,出现分层现象的是四氯化碳,溶液变为紫色的是苯酚溶液,溶液由无色变为褐或黄色的是碘化钠溶液,无明显变化的是氯化钠溶液,因为四氯化碳不溶于水、密度比水大,苯酚遇氯化铁溶液变紫色,铁离子将碘离子氧化为单质碘,故C正确;配制一定物质的量浓度溶液时,玻璃棒其搅拌、引流作用,粗盐提纯过程中,玻璃棒先后起搅拌、引流作用,故D正确。
本题难度:简单