检验气体中含有乙烯
参考答案:A
本题解析:A正确,先加足量溴水,使己烯充分与溴加成达饱和,然后再加入酸性高锰酸钾溶液,若溶液褪色即可说明己烯中是否混有少量甲苯。
B错,将石油裂解气通入酸性高锰酸钾,溶液褪色只能说明含有碳碳双键的气体,但并不一定是乙烯。
C错,检验淀粉水解产物有还原性的操作方法为:淀粉溶液和稀H2SO4混合加热,冷却后加入足量的氢氧化钠溶液中和硫酸,后加新制的Cu(OH)2悬浊液加热至沸腾,若有红色沉淀生成,即可说明淀粉水解产物有还原性。
D错,将乙醇与浓硫酸共热制得的气体中有少量乙醇蒸气,乙醇蒸气也能使酸性KMnO4溶液褪色,即不足以说明含有乙烯气体;
本题难度:简单
2、实验题 (10分)下图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。
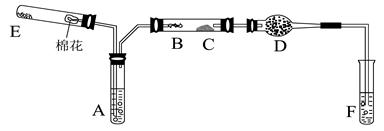 ? ?
图中:A为无水乙醇(沸点为78℃),B为绕成螺旋状的细铜丝或银丝,C为无水CuSO4粉末,D为碱石灰,F为新制的碱性Cu(OH)2悬浊液。?
(1)在上述装置中,实验时需要加热的仪器为(填仪器或某部位的代号)?。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是_____________。
D处使用碱石灰的作用是?。?
(3)检验乙醇氧化产物时F中的实验现象是?。
(4) E处是一种纯净物,其反应方程式为?。
(5)写出乙醇发生催化氧化的化学方程式?。
参考答案:.共10分
(1)E、A、B、F(漏选得1分,多选、错选不得分)?,(2分)
(2)水浴加热?(1分)
防止F中的水蒸气进入C中与无水CuSO4作用,影响产物水的检验。(2分)
(3)F中产生红色沉淀。(1分)
(4)2KMnO4=K2MnO4+MnO2+O2↑。(2分)
(5)2CH3CH2OH+O2→2CH3CHO+2H2O(2分)
本题解析:略
本题难度:简单
3、选择题 下列实验方案合理的是( )
A.鉴别甲烷和乙烯:分别点燃,观察火焰的颜色及是否有黑烟
B.检验酒精中的少量水:向酒精中加入足量生石灰
C.制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应
D.验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液观察是否出现黄色沉淀
参考答案:A、甲烷中的含碳量小于乙烯中的含碳量,所以乙烯燃烧会出现黑烟,但是甲烷不会,故A正确;
B、酒精中是否有水可以用无水硫酸铜检验,水可以使之变蓝,故B错误;
C、乙烷和氯气的混合气放在光照条件下反应的产物是混合物,最多的是氯化氢,故C错误;
D、验证某RX是碘代烷的方法:把RX与烧碱水溶液混合加热后,加入硝酸酸化,再将溶液冷却后再加入硝酸银溶液观察是否出现黄色沉淀,故D错误.
故选A.
本题解析:
本题难度:一般
4、简答题 为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
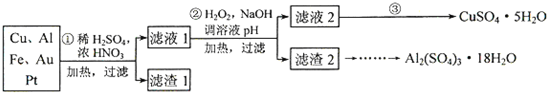
(1)第①步Cu与混酸反应的离子方程式为______.得到滤渣1的主要成分为______.
(2)第②步中加入H2O2的作用是______,使用H2O2的优点是______;调溶液pH的目的是______.
(3)简述第③步由滤液2得到CuSO4?5H2O的方法是______.
(4)由滤渣2制取Al2(SO4)3?18H2O,设计了以下三种方案:

上述三种方案中,______方案不可行,原因是______;从原子利用率角度考虑,______方案更合理.
(5)用滴定法测定CuSO4?5H2O含量.取ag试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用
cmol/LEDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL.滴定反应如下:
Cu2++H2Y2-→CuY2-+2H+.写出计算CuSO4?5H2O质量分数的表达式ω=______.
参考答案:(1)稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第①步Cu与酸反应的离子方程式为:Cu+4H++2NO3-△.Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-△.3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以是滤渣;
故答案为:Cu+4H++2NO3-△.Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-△.3Cu2++2NO↑+4H2O,Au、Pt;
(2)第②步加H2O2的作用是将Fe2+氧化为Fe3+,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,
故答案为:将Fe2+氧化为Fe3+;不引入杂质,对环境无污染;使Fe3+、Al3+沉淀除去;
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
故答案为:加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体;
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,
甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行;乙和丙方法均可行;乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;
丙方案先在滤渣中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体;但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费,
所以从原子利用率和是否产生杂质考虑知,乙更合理,
故答案为:甲;所得产品中含有较多Fe2(SO4)3杂质;乙.
(5)取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol?L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
铜离子物质的量和标准液物质的量相同,则20mL溶液中铜离子的物质的量=cmol/L×b×10-3L=bc×10-3mol;
则ag样品中CuSO4?5H2O的质量=c×b×10-3mol×250g/mol×5,所以CuSO4?5H2O质量分数的表达式=c×b×10-3×250×5a×100%.
故答案为:c×b×10-3×250×5a×100%.
本题解析:
本题难度:一般
5、填空题 (12分)甲、乙两人分别用不同的方法配制100mL 3.6mol/L的稀硫酸。
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为?
(2)甲:量取18 mol/L的浓硫酸?mL,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小 心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。 心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①实验所用的玻璃仪器除烧杯和容量瓶外,还有?、?、?;
②使用容量瓶前必须进行的一步操作是?
③ 定容的正确操作是?
(3)乙:用100 mL量筒量取20 mL浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加水至100 mL 刻度线,再搅拌均匀。
你认为此法是否正确?若不正确,指出其中 错误之处? 错误之处?
参考答案:(12分)(1)②①③⑧⑤⑥⑦④ (2分,错排不得分)
(2)20 (2分)?① 量筒、玻璃棒、胶头滴管(3分,每个1分);② 检查是否漏水(1分);③ 加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切(2分)。
(3)不能用量筒配制溶液,不能将水加入到浓硫酸中(2分)
本题解析:略
本题难度:一般
|