| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《盐类水解的原理》高频试题预测(2017年最新版)(四)
参考答案:B 本题解析:A、混合后溶液中存在电荷守恒为:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-) +2c( C2O42-), A错误;B、根据NaHSO4溶液中的电荷守恒得:c(H+)+c(Na+)=c(OH-)+2c(SO42-),根据物料守恒得c(Na+)= c(SO42-),所以得c(H+)= c(OH-)+c(SO42-), B正确;C、Na2S溶液中,S2-第一步水解生成HS-,S2-两步水解都生成OH-,所以c(HS-) <c(OH-),C错误;D、由于氨水是弱碱,部分电离,氯化氢是强电解质,常温下,pH=2的盐酸溶液浓度小于pH=12的氨水浓度,二者等体积混合,氨水过量导致溶液呈碱性,则c(NH4+)>c(OH-)>c(H+),D错误。答案选B。 本题难度:一般 2、选择题 25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是 |
参考答案:B
本题解析:A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中,由于铵根离子会发生水解反应消耗,所以c(SO42-)>c(NH4+);根据物料守恒可知:c(NH4+)>c(Fe2+);铵根离子、亚铁离子水解消耗水电离产生的OH-,破坏了水的电离平衡,最终使溶液显酸性,所以c(H+)> c(OH-);但是盐的水解程度是微弱的,盐电离产生的离子浓度大于水电离产生的离子浓度,所以c(Fe2+)>c(H+)。故溶液中离子的浓度关系是:c(SO42-)> c(NH4+) > c(Fe2+)>c(H+),正确;B.一水合氨是弱碱,当pH =11的氨水和pH=3的盐酸溶液等体积混合时,弱碱电离产生的离子恰好与盐酸中和,未电离的碱的分子会继续电离,所以溶液显碱性,c(OH-)>c(H+);c(NH4+)>c(Cl-),但是强电解质盐电离产生的离子浓度大于弱电解质一水合氨的电离,所以c(Cl-)> c(OH-),故离子浓度关系是:所得溶液中:c(NH4+)>c(Cl-)> c(OH-)>c(H+),错误;C.根据物料守恒可得在0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH) =" 0.1" mol/L, 正确;D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后所得溶液是CH3COOH和CH3COONa等物质的量的混合溶液。因为溶液显酸性:说明醋酸的电离作用大于CH3COO-水解作用,所以c(CH3COO-)>c(Cl-) >c(CH3COOH),酸的电离作用是微弱的,所以c(CH3COOH)>c(H+),因此微粒浓度关系是c(CH3COO-)>c(Cl-) >c(CH3COOH) >c(H+),正确。
考点:考查溶液中微粒的物质的量浓度关系的知识。
本题难度:一般
3、填空题 (10分)
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
参考答案:(1) O2+4e-+2CO2=2CO32-;负;(2)4.2×10-7 mol·L-1;
(3) > ;HCO3- +H2O CO32-+H3O+ (或 HCO3-
CO32-+H3O+ (或 HCO3- CO32-+H+);
CO32-+H+);
HCO3-+H2O H2CO3 +OH-、HCO3-的水解程度大于电离程度
H2CO3 +OH-、HCO3-的水解程度大于电离程度
本题解析:(1)在该燃料电池中,正极上是O2得到电子与CO2结合形成CO32-,电极反应式是:O2+4e-+2CO2 =2CO32-电池放电时,根据同种电荷相互排斥,异种电荷相互吸引的原则,CO32-移向正电荷较多的电池的负极;
(2)H2CO3 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=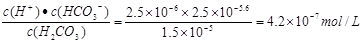 ;
;
(3)在常温下,在NaHCO3溶液中存在HCO3-的电离作用HCO3- CO32-+H+和HCO3-的水解作用HCO3-+H2O
CO32-+H+和HCO3-的水解作用HCO3-+H2O H2CO3 +OH-,电离使溶液显酸性,水解使溶液显碱性,由于0.1mol/L的NaHCO3溶液pH大于8,说明其水解作用大于电离作用,则溶液c(H2CO3)> c(CO32-)。
H2CO3 +OH-,电离使溶液显酸性,水解使溶液显碱性,由于0.1mol/L的NaHCO3溶液pH大于8,说明其水解作用大于电离作用,则溶液c(H2CO3)> c(CO32-)。
考点:考查燃料电池的各种原理、电离平衡常数的应用及盐的水解和电离的应用的知识。
本题难度:一般
4、选择题 根据下表提供的数据,下列判断正确的是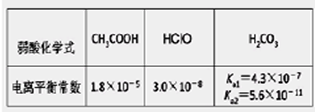
A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有: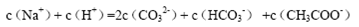
B.常温下,已知酸H2A存在如下平衡: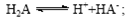 ;
;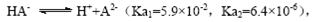 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+)
D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
参考答案:D
本题解析:A、根据电荷守恒规律,等物质的量的Na2CO3和CH3COOH两种溶液混合一定有c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)+ c(HCO3-)+2 c(CO32-),错误;B、H2A为二元弱酸,则NaHA溶液的酸碱性未知,HA-的水解与电离程度的强弱无法判断,所以NaHA溶液中水的电离程度与纯水中水的电离程度无法比较,错误;C、 根据电离平衡常数可知,醋酸的酸性大于次氯酸,所以同浓度的醋酸钠与次氯酸钠的混合液中次氯酸根离子的水解程度大于醋酸根离子的水解程度,溶液呈碱性,则溶液中离子的浓度关系是c(Na+)> c(CH3COO-)> c(ClO-)> c(OH-)>c(H+),错误;D、常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当 c(CH3COOH):c(CH3COO-)=5:9时,根据醋酸的电离常数K=1.8×10-5= c(CH3COO-)c(H+)/ c(CH3COOH),则c(H+)=1×10-5mol/L,所以溶液的pH=5,正确,答案选D。
考点:考查电解质溶液中离子浓度的关系比较,电离常数的应用
本题难度:一般
5、选择题 常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述不正确的是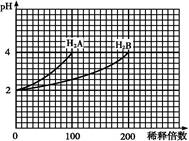
A.H2A为二元强酸
B.pH=4的NaHA水溶液中离子浓度大小为:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合溶液中,离子浓度大小为:c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B)
D.Na2B的水溶液中,离子浓度大小为:c(Na+)>c(B2-)>c(OH-)>c(H+)
参考答案:B
本题解析:A、从图分析,H2A稀释100倍,pH改变了2,说明是强酸,正确,不选A;B、H2A为二元强酸,所以NaHA水溶液中没有HA-和H2A,所以选B;C、H2B稀释100倍,pH变化小,说明是弱酸,所以HB-能电离也能水解,在含NaHA、NaHB的混合溶液中存在物料守恒,c(Na+)=c(A2-)+c(HB-)+c(B2-)+c(H2B),正确,不选C;D、Na2B的水溶液中B2-水解使溶液显碱性,所以正确,不选D。 考点:盐类的水解,溶液的离子浓度的比较,强弱电解质的判断
考点:盐类的水解,溶液的离子浓度的比较,强弱电解质的判断
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《难溶电解质.. | |