| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《难溶电解质的溶解平衡》考点特训(2017年冲刺版)(一)
3、填空题 (8分)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) 4、填空题 (13分)Ⅰ、短周期元素X、Y、Z在元素周期表中的相对位置如下图所示。
(1)Y的离子结构示意图为 。 (2)X、Z的气态氢化物稳定性较强的是 (填化学式)。 (3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是 (用离子方程式表示)。 (4)工业上,用X单质制取Z单质的化学方程式为 。 (5)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为 。(已知25℃,X的最高价氧化物的水化物的电离常数为Kal =4.2×10-7,Ka2=5.6×10-11;HA的电离常数Ka=1.1×10-10) Ⅱ、碳和氮的化合物与人类生产、生活密切相关。低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。 已知:CO(g) + H2O(g)  H2(g) + CO2(g)的平衡常数随温度的变化如下表: H2(g) + CO2(g)的平衡常数随温度的变化如下表:
(6)上述正反应方向是 反应(填“放热”或“吸热”)。 (7)写出该反应的化学平衡常数表达式:K= 。 (8)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。 (9)在一恒温、恒容密闭容器中发生反应:Ni (s)+4CO(g) 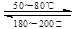 Ni(CO)4(g),ΔH<0。 Ni(CO)4(g),ΔH<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。 A.增加Ni的量可提高CO的转化率,Ni的转化率降低 B.缩小容器容积,平衡右移,ΔH减小 C.反应达到平衡后,充入CO再次达到平衡时, CO的体积分数降低 D.当4v正[Ni(CO)4]= v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 5、选择题 向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为(? ) |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《离子反应》.. | |