微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 表中元素周期表短周期的一部分.回答下列问题:
(1)E元素原子核外最外层有______个电子;请从物质的类别、化合价二方面归纳该元素+4价氧化物的化学性质:______.
(2)请指出G的非金属性比E的非金属性强的事实(写3点)______.
(3)E、G元素的原子均可形成与M原子电子层结构相同的简单离子,且E离子的半径更大,请解释______.
(4)A与氢元素形成分子的空间结构可能是(选填序号)______.

参考答案:根据元素所在周期表中的位置,A可能为B元素,也能为N元素,结合题中(3)E、G元素的原子均可形成与M原子电子层结构相同的简单离子,可知M为零族元素,应为Ar元素,则A为C元素,D为O元素,E为S元素,G为Cl元素,则
(1)E为S元素,最外层电子数为6,最高化合价为+6价,对应的+4价氧化物为SO2,为酸性氧化物,处于中间价态,既具有氧化性,又具有还原性,
故答案为:6;具有酸性氧化物的通性;既有氧化性又有还原性;
(2)比较非金属性强弱可根据氢化物的稳定性、最高价含氧酸酸性以及单质之间的置换反应实验证明,
故答案为:G的氢化物更稳定、G的最高价含氧酸酸性更强、G的单质能把E的单质置换出来;
(3)同周期非金属元素对应的阴离子,从左到右核电核数逐渐增大,对外层电子的引力逐渐增强,则对应的离子半径逐渐减小,
故答案为:G离子的核电荷数更大,对外层电子的引力更强;
(4)A为C元素,C原子最外层4个电子,能够形成4个共价单键,由图可知,c为甲烷,d为苯,故答案为:c、d.
本题解析:
本题难度:简单
2、填空题 如图所示每条折线表示周期表ⅣA~ⅦA族中某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是____________,b点代表的是__________。
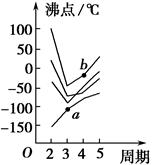
参考答案:SiH4? H2Se
本题解析:第二周期ⅣA~ⅦA族元素分别是C、N、O、F,其氢化物的沸点由高到低的顺序是
H2O>HF>NH3>CH4,因此,由上至下4条折线分别代表ⅥA、ⅦA、ⅤA、ⅣA族元素的氢化物的沸点变化。那么,b点代表的物质是H2Se,a点代表的物质是SiH4。
本题难度:一般
3、选择题 下列各组物质汽化或熔化时,所克服的粒子间的作用(力)属同种类型的是
[? ]
A.碘和干冰的升华
B.二氧化硅和生石灰的熔化
C.氯化钠和铁的熔化
D.苯和乙烷蒸发
参考答案:AD
本题解析:
本题难度:一般
4、选择题 【南海中学2008届高三化学第一次月考】将下列物质分别加到溴水中,振荡后,因发生化学变化而使溴水褪色的是:①硫化钠②氢氧化钠③乙酸④镁粉⑤裂化汽油⑥甲苯
A.①②③⑤
B.②④⑤⑥
C.①②④⑤
D.②③④⑤
参考答案:C
本题解析:硫化钠可以被溴水氧化;氢氧化钠和溴水反应生成无色的盐溶液;镁粉和溴水生成MgBr2;裂化汽油含有烯烃,可以和溴水加成。
本题难度:一般
5、选择题 下列物质的电子式书写正确的是( )
A.次氯酸
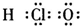
B.过氧化
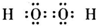
C.氨基
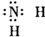
D.二氧化碳
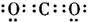
参考答案:D
本题解析:
本题难度:简单