微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
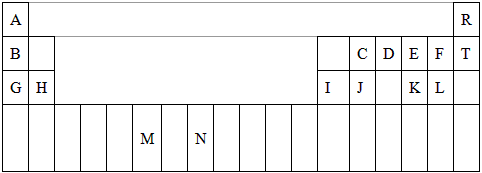
|
试回答下列问题
(1)请写出G的淡黄色化合物与二氧化碳反应的方程式________________________。
(2)D的气态氢化物的VSEPR模型为__________,其中心原子的杂化类型为__________________。
(3)G、H和I的第一电离能数值由大到小的顺序为:______________________(用元素符号作答)。
(4)由A、C、D形成的ACD分子中,含有__________个σ键,__________个π键。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
请回答下列问题
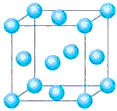
①与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有_______________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为_______________。
②MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是__________(填“极性”或“非极性”)分子。
③在C2H4、CH3Cl、CH2O、CS2、CCl4五种有机化合物中,碳原子采取sp2杂化的分子有___________________________(填分子式)。
参考答案:(1)2Na2O2+2CO2=2Na2CO3+O2
(2)四面体;sp3
(3)Mg>Al>Na
(4)2;2
(5)①K、Cu;4;②非极性;③ C2H4、CH2O
本题解析:
本题难度:一般
2、选择题 下列有关说法不正确的是
A.能使品红试液褪色的气体不一定是SO2
B.胶黏剂UF结构为: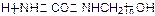 ,可推测其单体为尿素和甲醇
,可推测其单体为尿素和甲醇
C.CO2电子式为
D. 命名为4-甲基-2-戊烯
命名为4-甲基-2-戊烯
参考答案:B
本题解析:A:能使品红溶液褪色的气体有:Cl2、O3、SO2等。
B:单体为尿素和甲醛。
C、D正确。
本题难度:一般
3、选择题 下列说法中,正确的是( )
A.双原子分子中的共价键,一定是非极性键
B.任何原子的原子核都是由质子和中子构成的
C.非极性键也可能存在于离子化合物中
D.质子数相同的微粒,它们的化学性质基本相同
参考答案:A.双原子分子中的共价键也可能是极性键,如HF,故A错误;
B.氕中只有质子而没有中子,故B错误;
C.离子化合物中一定含有离子键,可能含有非极性键,如Na2O2,存在O-O非极性键,属于离子化合物,故C正确;
D.具有相同质子数的原子一定属于同种元素,但微粒可能为原子、分子、离子等,如Na+、NH4+的质子数都是11,HF、Ne的质子数都是10,但不是同种元素,化学性质不同,故D错误.
故选C.
本题解析:
本题难度:简单
4、简答题 有X、Y、Z、W四种短周期元素,原子序数依次增大.其核电荷数总和为38,Y元素原子最外层电子数占核外电子总数的3/4;W元素原子最外层比同周期Z元素多5个电子,W和Y不属于同一主族.
(1)写出元素符号:X______,Y______,Z______.
(2)W元素最高价氧化物对应的水化物的化学式是______.
(3)X、Y两种元素形成的化合物的化学式有______.
参考答案:X、Y、Z、W四种短周期元素,原子序数依次增大,由Y元素原子最外层电子数占核外总电子数的34,最外层电子数不超过8,故核外电子总数小于11,且为4的倍数,核外总电子为8符合,则最外层电子数为6,即Y为氧元素;W和Y不属于同一主族,W元素原子最外层电子数比同周期Z元素原子最外层电子数多5个电子,则W处于ⅦA族,Z处于ⅡA族,Z原子序数大于氧元素,则W、Z处于第三周期,故W为氯,Z为镁;四元素核电荷数总和为38,X的核电荷数为38-8-12-17=1,则X为氢元素,
(1)由上述分析可知,X为H、Y为O、Z为Mg,故答案为:H;O;Mg;
(2)W为氯,其最高价氧化物对应的水化物的化学式是HClO4,故答案为:HClO4;
(3)H、O两种元素形成的化合物的化学式有H2O、H2O2,故答案为:H2O、H2O2.
本题解析:
本题难度:一般
5、填空题 【选修3:物质结构与性质】(10分)
血红素中含有C、O、N、Fe五种元素。回答下列问题:
(1)C、N、O、H四种元素中电负性最小的是?(填元素符合),写出基态Fe原子的核外电子排布式?。
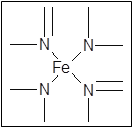
(2)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。血红素中N原子的杂化方式有?,在右图的方框内用“→”标出Fe2+的配位键。
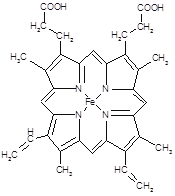 ?
?
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(4)N与H形成的化合物肼(N2H4)可用作火箭燃料,燃烧时发生的反应是:
2N2H4(l)+ N2O4(l)=3N2(g)+ 4H2O(g)?△H=-1038.7kJ/mol
若该反应中有4mol N—H键断裂,则形成的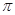 键有___________mol。
键有___________mol。
(5)根据等电子原理,写出CN—的电子式?,1 mol O22+中含有的π键数目为?。
(6)铁有δ、γ、α三种同素异形体如下图所示。则γ晶体晶胞中所含有的铁原子数为?,δ、α两种晶胞中铁原子的配位数之比为?。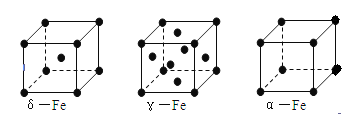
参考答案:(1)H;[Ar]3d64S2?(2)sp2、sp3;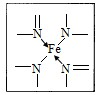 (3)>?(4)3
(3)>?(4)3
(5)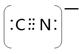 ;2NA?(6)4;4:3
;2NA?(6)4;4:3
本题解析:(1)同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,H的电负性最小。铁的原子序数是26,根据核外电子排布规律可知,基态Fe原子的核外价电子排布式为[Ar]3d64S2。(2)形成双键的N原子空间构型为平面,所以为sp2杂化,形成单键的N原子,与NH3杂化相同,可知应该是sp3杂化;N原子最外层有5个电子,只需要形成3条键即可达到稳定结构,但是图中形成双键的N原子形成了四条键,显然有一条为配位键,可表示为 。
。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高.由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO。
(4)N2H4中含有4个N-H单键,根据化学方程式可知,若反应中有4mol N—H键断裂,则必然生成1.5mol氮气。氮气中含有氮氮三键。而三键含有1个σ键和2个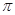 键,因此反应中形成的
键,因此反应中形成的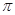 键有1.5mol×2=3mol。
键有1.5mol×2=3mol。
(5)价电子数与原子数分别都相等的是等电子体,CN-与 氮气互为等电子体,则根据氮气分子的电子式写出CN-的电子式,且CN-是离子,符合离子电子式的书写规则,所以其电子式为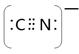 ;O22+与氮气也互为等电子体,则1 mol O22+中含有的π键数目为2NA。
;O22+与氮气也互为等电子体,则1 mol O22+中含有的π键数目为2NA。
(6)γ晶体晶胞中所含有的铁原子数为8× +6×
+6×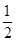 =4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3。
=4,δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3。
本题难度:一般