微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在反应3S+6KOH=2K2S+K2SO3+3H2O中,被还原的硫与被氧化的硫的质量比为(?)
A.2:1
B.1:2
C.3:1
D.1:3
参考答案:A
本题解析:略
本题难度:一般
2、选择题 铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
(1)□Fe(NO3)3+□NaOH+□Cl2===□Na2FeO4+□NaNO3+□NaCl+□H2O
(2)在上述反应中 元素被氧化,当3molCl2参与反应时,转移电子的总数为 ;
(3)铁酸钠之所以能净水,除了能氧化杀菌外,另一个原因是 。
参考答案:(9分)
⑴(3分)2、16、3、2、6、6、8 (2)(4分)Fe(或铁)、 3.612×1024
(3)(2分)还原产物Fe3+与水反应生成Fe(OH)3胶体,能吸附杂质。
本题解析:(1)根据电子守恒配平铁从正三价升高到正六价转移3个电子,氯气从0价到负一转移2个电子,最小公倍数是6,即可配平。(2)中铁元素化合价升高失电子被氧化。3mol氯气到氯离子转移6mol电子既是3.612×1024 (3) 还原产物Fe3+与水反应生成Fe(OH)3胶体,胶体的比表面积比较大能吸附杂质。
考点:氧化还原反应的配平及相关概念。
本题难度:一般
3、填空题 实验室里迅速制备少量氯气可利用以下反应:
______KMnO4+______?HCl═______?KCl+______?MnCl2+______?Cl2↑+______?H2O
(1)请配平上述化学方程式,并在上面用“双线桥法”标明电子转移的方向和数目:
(2)该反应的氧化产物是______,KMnO4发生______反应.
(3)HCl在上述反应中显示出来的性质是______.
A.氧化性?B.还原性?C.酸性?D.碱性
(4)用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为______mol,需要KMnO4的质量______g,转移电子数为______.
参考答案:(1)反应中HCl→Cl2,氯元素化合价由-1价升高为0价,共升高2价,KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为10,故KMnO4系数为2,故Cl2系数为5,根据Mn元素守恒可知MnCl2系数为2,根据K元素守恒可知KCl系数为2,根据Cl元素守恒可知HCl系数为16,根据H元素可知H2O的系数为8,配平后方程式为:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8?H2O,用“双线桥法”标明电子转移的方向和数目为:
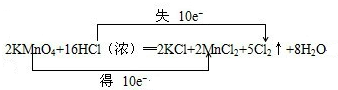
;
故答案为:2、16、2、2、5、8;

(2)反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,Cl2是氧化产物;
反应KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,KMnO4是氧化剂,发生还原反应;
故答案为:Cl2;还原;
(3)由方程式可知,反应后KCl、Cl2中含有氯元素,KCl中氯元素化合价为-1价,Cl2中氯元素化合价为0价,说明反应中HCl表现酸性、还原性;
故选BC;
(4)560mlCl2的物质的量为0.56L22.4L/mol=0.025mol,被氧化的HCl为生成Cl2,根据氯元素守恒可知被氧化的HCl为0.025mol×2=0.05mol;
根据2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8?H2O可知,生成0.025molCl2,需要KMnO4的物质的量为:0.025mol×25=0.01mol,质量为0.01mol×158g/mol=1.58g;
反应中HCl→Cl2,氯元素化合价由HCl中-1价升高为Cl2中0价,故转移电子物质的量为0.025mol×2=0.05mol,转移电子数目为0.05mol×NAmol-1=0.05NA;
故答案为:0.05;1.58;0.05NA.
本题解析:
本题难度:简单
4、选择题 亚硝酸钠是一种防腐剂和增色剂,但在食品中过量时会对人体产生危害。其在酸性条件
下会产生NO和NO2。下列有关说法错误的是( )
A.NaNO2既具有氧化性又具有还原性
B.食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害
C.NaNO2和胃酸作用的离子方程式为:
2NO2—+2H+=NO↑+NO2↑+H2O
D.1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol
参考答案:D
本题解析:NaNO2中的氮元素的化合价为+3价,既能升高又能降低,A正确;食醋中含有乙酸,可与亚硝酸钠作用而使其损耗,B正确;胃酸属于强酸,NaNO2是易溶于水的强电解质,C正确;根据C中离子方程式分析可知;1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量应为0.5 mol,D不正确。
本题难度:一般
5、选择题 在反应8NH3 + 3Cl2= 6NH4Cl + N2中,被氧化的氨与未被氧化的氨的物质的量之比为:(?)
A.8∶3
B.6∶1
C.3∶1
D.1∶3
参考答案:D
本题解析:略
本题难度:简单