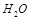|
高中化学知识点总结《未知》试题预测(2017年最新版)(二)
2017-08-26 00:40:03
来源:91考试网
作者:www.91exam.org 【 大 中 小】
 +?OH +?OH ————? ————?
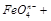 ? ?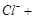 ? ?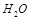
参考答案:(1)Ca(ClO)2 (1分)
(2)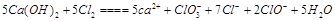 ?(2分) ?(2分)
(3)5 (1分)? (4)D? (1分)? (5)2,? (5-n),? 2n,? (5-n)? (n+3) (2分)
本题解析:(1)Ca(ClO)2;t1时间,Cl2只有失去电子生成了ClO-
(2) 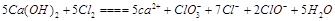 ?根据得失电子守恒进行配平,最后ClO-与ClO3-的比例符合2比1。生成物根据元素守恒判断,氯气的价态即能升高到+1价和+3价,还有降低到-1价,所以生成了Cl-。 ?根据得失电子守恒进行配平,最后ClO-与ClO3-的比例符合2比1。生成物根据元素守恒判断,氯气的价态即能升高到+1价和+3价,还有降低到-1价,所以生成了Cl-。
(3)根据方程式计算,有图像可知ClO-为2mol?,最后氯气过量,所以Ca(OH)2的物质的量是5mol。
(4)NaClO2中氯的价态是+3价,发生歧化反应,即升高价态生成? NaClO3又降低价态生成NaCl。?
(5)根据得失电子守恒来配平,首先标出生成物 FeO4n-中Fe的价态为8-n,所以Fe变化的价态为8-n-3,即5-n。反应物中氯的价态为+1价,生成的氯为-1价,所以变化的价态为2,取最小公倍数2(5-n),所以反应物种氢氧化铁前面配2,氯气前面配(5-n),ClO-前面配(5-n)。最后根据O元素守恒,H元素守恒,OH 前面配2n, 前面配2n, 前面配n+3。 前面配n+3。
点评:本题考查比较综合,难点在于离子反应方程式的书写,以及利用氧化还原反应中得失电子守恒的原理。
本题难度:一般
2、选择题 实验室可通过以下反应来制取碘:2NO+O2=2NO2;2H++2I-+NO2=NO+I2+H2O
在这一过程中,每制取l mol I2时,所消耗氧化剂的质量是(? )
A.28g
B.16g
C.329
D.46g
参考答案:B
本题解析:
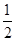 O2 O2 NO2 NO2 ?I2 ?I2
0.5mol? 1mol
0.5mol的氧气的质量为16克,选B
本题难度:一般
3、选择题 有一未完成的离子方程式为: +XO3-+6H+=3X2+3H2O,据此判断,X元素的最高化合价为 +XO3-+6H+=3X2+3H2O,据此判断,X元素的最高化合价为
[? ]
A.+7
B.+4
C.+5
D.+1
参考答案:A
本题解析:
本题难度:简单
4、选择题 工业上冶炼铁有化学方程式如下:Fe2O3+3CO 2Fe+3CO2,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为(? ) 2Fe+3CO2,在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为(? )
A.3︰1
B.2︰3
C.1︰3
D.3︰5
参考答案:C
本题解析:氧化剂是Fe2O3,还原剂是CO,根据反应方程式,Fe2O3与CO的物质的量之比是1︰3,选C。
本题难度:简单
5、选择题 在SiO2+3C SiC+2CO↑反应中,氧化剂和还原剂的质量比为(? ) SiC+2CO↑反应中,氧化剂和还原剂的质量比为(? )
A.36∶30
B.60∶36
C.2∶1
D.1∶2
参考答案:D
本题解析:氧化剂是二氧化硅,还原剂是碳,物质的量比是1∶2,质量比是60∶36,故选B。
本题难度:简单
|  +?OH
+?OH ————?
————?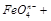 ?
?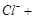 ?
?