微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
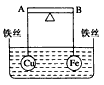
1、选择题 如下图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)
[? ]
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
参考答案:D
本题解析:
本题难度:一般
2、选择题 化学中常用图象直观地描述化学反应的进程或结果。下列图象描述正确的是(? )
参考答案:A
本题解析:A:合成氨过程中,正反应速率逐渐减小,逆反应速率由0逐渐增大,平衡时,由不同物质表示正逆反应速率时,数值上符合系数比,正确
B:通入氨气生成醋酸铵强电解质,溶液导电性增强,不正确
C:随着碳的时的增加,依次发生反应:C+O2=CO2? CO2+C=2CO,可见当碳小于1mol时,产物为CO2,当大于1mol后,CO2的量逐渐减小到0,而CO的量由0逐渐增大到2mol,不正确
D:由于发生:Ca2++HCO3-+OH-=CaCO3↓+H2O,故一开始就有沉淀生成,不正确
答案为A
本题难度:一般
3、填空题 (12分)右图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH

(1)请回答图中甲、乙两池的有关问题:甲池是?装置,B(石墨)电极的名称是?。
(2)写出电极反应式:通入O2的电极的反应式?。A(Pt)电极的反应式为?,
(3)乙池中反应的化学方程式为?。
(4)若乙池溶液体积为500mL,且忽略电解过程中溶液体积的变化,当乙池中A极的质量增加5.40g时:
①甲池中理论上消耗O?2体积为?(标准状况下);
②乙池中所得溶液的pH=?。
参考答案:
(1)原电池或化学能转变为电能的(1分),阳极(1分)
(2)O2+2H2O+4e-="=" 4OH-(2分)Ag++e-="=" Ag(2分)
(3)4AgNO3+2H2O
(4)① 280mL(2分);② 1(2分)
本题解析:略
本题难度:简单
4、选择题 原电池的反应原理是( )
A.储存电能
B.氧化还原反应
C.化合价升降
D.化学能转化为热能
参考答案:原电池可将化学能转变为电能,反应原理为氧化还原反应,工作时,负极发生氧化反应,正极发生还原反应.
故选B.
本题解析:
本题难度:简单
5、填空题 铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物
(1)要确定铁的某氯化物FeClx的化学式。可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预防处理,再通过含有饱和OH-的阴离子交换柱,使
Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol/L的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中X值
(2)现有一含有FeCl2和FeCl3的混合样品,采用上述方法测得n(Fe):?n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为_______________。在实验室中,FeCl2可用铁粉和____反应制备,
FeCl3可用铁粉和_______反应制备
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与
KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为______与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_______________,该电池总反应的离子方程式为________________。
参考答案:(1)n(Cl)=0.0250L×0.40mol·L-1=0.010mol
0.54g-0.010mol×35.5g·mol-1=0.19g
n(Fe)=0.19g/56g·mol-1=0.0034mol
n(Fe):?n(Cl)=0.0034:0.010≈1:3,x=3
(2)0.10;盐酸;氯气
(3)2Fe3++2I-=2Fe2++I2(或2Fe3++3I-=2Fe2++I3-)
(4)2Fe(OH)3+3ClO-+4OH-=2FeO42-+5H2O+3Cl-;FeO42-+3e-+4H2O=?Fe(OH)3+5OH-;
2FeO42-+8H2O+3Zn=2Fe(OH)3+3Zn(OH)3+4OH-
本题解析:
本题难度:一般