微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。
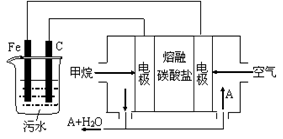
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________(填序号)。
a.H2SO4
b.BaSO4
c.Na2SO4
d.NaOH
e.CH3CH2OH
(2)电解池阳极发生两个电极反应,反应式分别是:①__________;②4OH——4e—= O2↑+2H2O;
(3)电极反应①和②的生成物发生反应得到Fe(OH)3的离子方程式是________________;
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂。已知负极的电极反应是CH4 + 4CO32— — 8e—="=" 5CO2 + 2H2O。
①正极的电极反应是___________________;
②为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环(见上图)。A物质的化学式是__________;
(5)实验过程中,若阴极产生44.8 L(标况)气体,则燃料电池消耗CH4(标况)_____L。
参考答案:(1)C(2分) (2)Fe — 2e—="=" Fe2+(2分)
(3)4Fe2+ + O2 + 10H2O ="=" 4Fe(OH)3 + 8H+(2分)
(4)O2 + 4e—+ 2CO2 = 2CO32—(2分) CO2(2分) (5)11.2L(2分)
本题解析:(1)要保持保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,因此加入能使溶液导电能力增强的电解质必须是可溶于水的、显中性的盐,答案选c;
(2)燃料电池中通入空气的电极是正极,通入甲烷的电极是负极。铁与正极相连作阳极,活泼金属电极做电解池的阳极时,电极本身失去电子,电极反应式为Fe-2e-=Fe2+;
(3)阳极铁失去电子转化为亚铁离子,亚铁离子具有还原性,能被氧气氧化生成铁离子,铁离子与氢氧根离子结合生成氢氧化铁红褐色沉淀,反应的离子方程式可表示为4Fe2++10H2O+O2=4Fe(OH)3↓+8H+;
(4)①燃料电池中,正极得到电子发生还原反应,即一定是氧气得电子的过程。由于电解质是熔融碳酸盐,因此正极电极反应为O2+2CO2+4e-=2CO32-;
②负极甲烷失去电子转化为CO2,而正极需要消耗CO2,所以可以循环利用的物质是二氧化碳;
(5)阴极电极反应为2H++2e-=H2↑,即44.8L(标准状况)气体是氢气,物质的量是2mol,转移电子的物质的量为4mol。根据电池的负极电极反应CH4+4CO32--8e-=5CO2+2H2O可知当转移4mol电子时,消耗CH40.5mol,在标准状况下的体积V=0.5mol×22.4L/mol=11.2L。
考点:考查电化学原理的应用
本题难度:困难
2、选择题 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是

[? ]
A. 断开K2,闭合K1一段时间,溶液的pH变大
B. 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-====H2↑
C. 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-====O2↑+2H2O
D. 断开K1,闭合K2时,OH-向b极移动
参考答案:B
本题解析:
本题难度:一般
3、选择题 我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池。常见镍氢电池的某极是贮氢合金LaNi5H6(LaNi5H6中各元素的化合价均视为0价),电池反应为
LaNi5H6 +6NiO(OH) 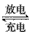 LaNi5+ 6Ni(OH)2。下列说法正确的是
LaNi5+ 6Ni(OH)2。下列说法正确的是
[? ]
A.放电时贮氢合金作正极
B.放电时负极反应为LaNi5H6 - 6e - ==LaNi5+6H+
C.充电时阳极周围c(OH -)减小
D.充电时贮氢合金作负极
参考答案:C
本题解析:
本题难度:一般
4、填空题 某一资料中记载着可以用电解KI水溶液的方法进行KIO3的工业化生产的信息,总的电解反应方程式为:KI+3H2O KIO3+3H2↑。
KIO3+3H2↑。
(1)据此推测:
①阳极反应式是?;
②阴极反应式是?。
(2)一位学生想演示这一方法,则他应该准备的物品和试剂是。
参考答案:(1)①I--6e-+3H2O
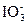 +6H+
+6H+
②6H2O+6e- 3H2↑+6OH-
3H2↑+6OH-
(2)KI溶液、直流电源、导线、两根石墨棒(只要阳极属于惰性电极就可以)、烧杯
本题解析:(1)①阳极是失电子、发生氧化反应的场所,因而氧化反应I-
 在阳极上进行。这一变化过程中失去6个电子,并且需要3个水分子提供3个氧原子,进而产物中会有6个H+生成。综合以上分析可写出阳极上的电极反应式为:I--6e-+3H2O
在阳极上进行。这一变化过程中失去6个电子,并且需要3个水分子提供3个氧原子,进而产物中会有6个H+生成。综合以上分析可写出阳极上的电极反应式为:I--6e-+3H2O
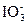 +6H+。②阴极是得电子、发生还原反应的一极,因而还原反应H2O
+6H+。②阴极是得电子、发生还原反应的一极,因而还原反应H2O H2↑在阴极上进行。根据阴阳极电子得失守恒的要求,这一变化过程中应该得到6个电子,导致产物中应该具有含有氧原子并带负电荷的粒子OH-。综合以上分析,可写出阴极上的电极反应式为6H2O+6e-
H2↑在阴极上进行。根据阴阳极电子得失守恒的要求,这一变化过程中应该得到6个电子,导致产物中应该具有含有氧原子并带负电荷的粒子OH-。综合以上分析,可写出阴极上的电极反应式为6H2O+6e- 3H2↑+6OH-。
3H2↑+6OH-。
(2)组成一个电解池需要直流电源、电解质溶液、导线、电源、容器等。
本题难度:简单
5、填空题 (共14分)(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0 B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为 。
(3)电解原理在化学工业中有着广泛的应用。
现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和
Y是两块电极板,则:
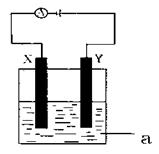
①若X和Y均为惰性电极,a为CuSO4
溶液,则电解时的化学反应方程式为 。
通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为 。
③若X、Y都是惰性电极,a是饱和NaCl溶液,则Y极的电极反应式为 ,
检验该电极反应产物的方法是 。
参考答案:⑴ C ⑵H2 - 2e- +2OH- =2H2O
⑶ ①2CuSO4+2H2O 2Cu+O2↑+2H2SO4;0.4mol ;②Cu - 2e- = Cu2+
2Cu+O2↑+2H2SO4;0.4mol ;②Cu - 2e- = Cu2+
③ 2Cl - - 2e - = Cl2 ↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色则有Cl2生成。
本题解析:化学反应若能设计为原电池吗,则应该满足:一是氧化还原反应,二是放热反应。对选项进行分析可知:只有C符合题意;(2)以KOH溶液为电解质溶液,将反应2H2(g)+O2(g)=2H2O(1) △H<0设计一个原电池,其负极是氢气,电极反应为H2 - 2e- +2OH- =2H2O;(3)①若X和Y均为惰性电极,a为CuSO4溶液,则应该是溶液中的离子放电,电解时的化学反应方程式为2CuSO4+2H2O 2Cu+O2↑+2H2SO4;通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则相当于反应发生产生了0.2mol的Cu和0.1mol的O2;则电解过程中转移的电子的物质的量为0.2×2mol=0.4mol。②若X、Y分别为铁和铜,a仍为CuSO4溶液,则阳极Y极的电极反应式为Cu - 2e- = Cu2+;③若X、Y都是惰性电极,a是饱和NaCl溶液,则是溶液中的阴离子Cl-放电,阳极Y极的电极反应式为2Cl - - 2e - = Cl2 ↑;检验该电极反应产物的方法是利用氯气的氧化性,把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色则有Cl2生成。
2Cu+O2↑+2H2SO4;通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则相当于反应发生产生了0.2mol的Cu和0.1mol的O2;则电解过程中转移的电子的物质的量为0.2×2mol=0.4mol。②若X、Y分别为铁和铜,a仍为CuSO4溶液,则阳极Y极的电极反应式为Cu - 2e- = Cu2+;③若X、Y都是惰性电极,a是饱和NaCl溶液,则是溶液中的阴离子Cl-放电,阳极Y极的电极反应式为2Cl - - 2e - = Cl2 ↑;检验该电极反应产物的方法是利用氯气的氧化性,把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色则有Cl2生成。
考点:考查原电池的构成原理、电解池原理、电极反应、物质的检验方法的知识。
本题难度:一般