微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、判断题 工业制铝是采用电解熔融的氧化铝的方法。试分析电解熔融的Al2O3的原理,写出有关的电极反应式及总反应式。
参考答案:阳极 6 O2-- 12 e-=3O2↑;阴极4 Al3++ 12 e-=4 Al。总反应式为:2 Al2O3?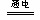 ?4 Al + 3O2↑。
?4 Al + 3O2↑。
本题解析:熔融氧化铝的中电离出自由移动的Al3+和O2-,在外加电源的作用下Al3+和O2-分别在阴、阳两极上放电得到对应的单质。熔融氧化铝的中自由移动的Al3+和O2-,其中O2-定向向阳极移动,在阳极上发生氧化反应:6 O2-- 12 e-=3O2↑;Al3+定向向阴极移动,在阴极上发生还原反应:4 Al3++ 12 e-=4 Al。总反应式为:2 Al2O3?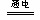 ?4 Al + 3O2↑。
?4 Al + 3O2↑。
本题难度:一般
2、填空题 (9分)近期“五水共治”越来越引起人们的重视。对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含乙酸钠和对氯酚( )的废水可以通过构成微生物电池除去,其原理如下图所示。
)的废水可以通过构成微生物电池除去,其原理如下图所示。
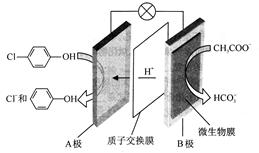
①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。

①阳极的电极反应式为 ;
②简述浓缩室中得到浓乳酸的原理 ;
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。400 mL10 g/L 乳酸溶液通电一段时间后,浓度上升为 145 g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为 L(乳酸的摩尔质量为90g/ mol )。
参考答案:(1) ①负 (1分) 
(2)①4OH- - 4e- = 2H2O + O2↑ (2分)
②阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室(1分);A-通过阴离子交换膜从阴极进入浓缩室,H++A— = HA,乳酸浓度增大(1分) ③ 6.72 (2分)
本题解析:(1)①根据装置图可知氢离子向A电极移动,这说明A电极是正极,则B电极是负极。
②A极是正极,得到电子发生还原反应,则电极反应式为 。
。
(2)①电解池中阳极失去电子发生氧化反应,阳极加入硫酸,则溶液中的氢氧根离子放电,电极反应式为4OH- - 4e- = 2H2O + O2↑。
②阳极OH-放电,导致溶液中c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,二者结合生成HA,即H++A—=HA,从而导致乳酸浓度增大。
③反应后增加的乳酸质量是0.4L×(145g/L—10g/L)=54g,物质的量是54g÷90g/mol=0.6mol,因此结合氢离子的物质的量是0.6mol,根据电荷守恒可知生成的氢气是0.3mol,在标准状况下的体积是6.72L。
考点:考查电化学原理的应用
本题难度:困难
3、填空题 (14分)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2.电池的总反应可表示为:4Li+2SOCl2 ==="4LiCl" +S +SO2
请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为__________________;
(2)电池正极发生的电极反应为_____________________________________;
(3)SOCl2易挥发 ,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,反应的化学方程式为______________________________
(4)组装该电池必须在无水、无氧的条件下进行,原因是______________________.
(5)用此电池电解(电极均为惰性电极)起始时盛有2000mL硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的c(H+)增加0.1mol/L,若要使溶液完全恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
参考答案:(1)锂 Li-e-===Li+,
(2)2SOCl2+4e-===4Cl-+S+SO2
(3)SOCl2+H2O===SO2↑+2HCl↑
(4)锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应
(5)氧化铜(或碳酸铜) 8g(或12.4g)
本题解析:(1)根据电池总反应,Li发生氧化反应,所以电池负极材料为Li,负极反应为Li-e-===Li+;(2)正极反应=电池的总反应—负极反应,正极反应为2SOCl2+4e-===4Cl-+S+SO2;(3)NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成,所以把少量水滴到SOCl2中,应该生成二氧化硫和氯化氢,化学方程式为SOCl2+H2O===SO2↑+2HCl↑;(4)锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应,所以组装该电池必须在无水、无氧的条件下进行;(5)电解硫酸铜溶液的总反应为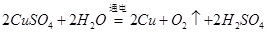 ,后溶液的c(H+)增加0.1mol/L,即生成硫酸0.1mol,生成铜0.1mol、。氧气0.05 mol,所以需要加入氧化铜8g或碳酸铜12.4g
,后溶液的c(H+)增加0.1mol/L,即生成硫酸0.1mol,生成铜0.1mol、。氧气0.05 mol,所以需要加入氧化铜8g或碳酸铜12.4g
考点:本题考查原电池原理。
本题难度:困难
4、实验题 (18分)废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备CoxOy,的工艺流程简图如下:

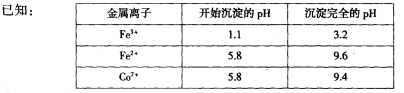
(1)电解时废旧刀具作阳极,不锈钢作阴极,盐酸的作用是______。
(2)通人氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择pH最大范围是____________。
(3)实验测得NH4HCO3溶液显碱性,制备CoCO3时,选用的加料方式是_______(填代号),原因是_______。
a.将滤液与NH4HCO3溶液同时加入到反应容器中
b.将滤液缓慢加入到盛有NH4HCO3溶液的反应容器中
c.将NH4HCO3溶液缓慢加入到盛有滤液的反应容器中
写出生成CoCO3的离子方程式______________________________________。
(4)实验中获得的若洗涤不充分,在焙烧时会产生污染性气体,该污染性气体的成分为_______________(填化学式)。
(5)实验室用下列装置制取 ,并测定其化学式。
,并测定其化学式。
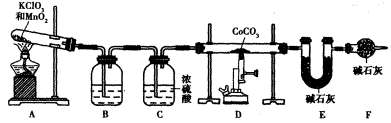
①装置A制得的中含有少量Cl2,则装置B中所盛放的试剂为______(填代号)。
a.NaHCO3溶液? b.NaOH溶液? c.KMnO4溶液? d.饱和NaCI溶液
②在CoCO3完全转化为 后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成物
后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成物 的化学式为____________。
的化学式为____________。
③若缺少装置F,则导致 的值______(填“偏大”、“偏小”或“无影响”)。
的值______(填“偏大”、“偏小”或“无影响”)。
参考答案:(l)作电解质溶液。(2)3.2≤pH<5.8。
(3)c,防止生成氢氧化钴沉淀;Co2++2HCO3— CoCO3↓+CO2↑+H2O。(4)HCl和NH3。(5)①b;②Co2O3。③偏大。
CoCO3↓+CO2↑+H2O。(4)HCl和NH3。(5)①b;②Co2O3。③偏大。
本题解析:由题给工艺流程知,以盐酸为电解质溶液,以废旧刀具作阳极,不锈钢作阴极,进行电解,生成WC,溶液中含有亚铁离子和Co2+,加入双氧水,将亚铁离子氧化为铁离子,通入氨气,调节pH在3.2到5.8之间,将铁离子转化为氢氧化铁沉淀过滤除去,滤液中含有Co2+,加入碳酸氢铵溶液生成碳酸钴,焙烧生成CoxOy。(l)电解时废旧刀具作阳极,不锈钢作阴极,盐酸的作用是作电解质溶液。(2)通人氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择pH最大范围是3.2≤pH<5.8。(3)实验测得NH4HCO3溶液显碱性,制备CoCO3时,为防止生成氢氧化钴沉淀,选用的加料方式是c.将NH4HCO3溶液缓慢加入到盛有滤液的反应容器中。生成CoCO3的离子方程式为Co2++2HCO3— CoCO3↓+CO2↑+H2O。(4)实验中获得的若洗涤不充分会含有氯化铵杂质,在焙烧时氯化铵分解会产生污染性气体HCl和NH3。(5)由题给装置图可知,实验通过测定装置E中的增重,确定生成的二氧化碳的质量,再利用n(C)=n(Co)可知CoxOy中Co的物质的量,进而计算Co的质量,装置D管内残留物质是CoxOy,计算出氧元素质量,再计算氧原子的物质的量,根据原子物质的量之比确定化学式。①装置A中制得的O2中含有少量的Cl2,B装置中所盛放的物质用于吸收Cl2,a、饱和NaHCO3溶液可以吸收氯气,但生成二氧化碳,影响二氧化碳质量的测定,错误;b、NaOH溶液可以吸收氯气,氧气的量不变,正确;c.c.KMnO4溶液不能吸收氯气,错误;d.饱和NaCl溶液不能吸收氯气,错误;选b;②E管增重4.40g是二氧化碳的质量,物质的量为0.1mol,根据化学式CoCO3可知,n(Co)=n(C)=0.1mol,Co的质量为0.1mol×59g/mol=5.9g,D管内残留物质的质量8.30g是CoxOy的质量,CoxOy中氧元素质量为8.3g-5.9g=2.4g,氧原子的物质的量n(O)=0.15mol,n(Co):n(O)=0.1mol:0.15mol=2:3,该钴的氧化物的化学式为Co2O3。③缺少F装置,装置E中碱石灰可以吸收空气中水蒸气、二氧化碳,造成二氧化碳质量偏大,进而Co的质量偏大,x/y的值偏大。
CoCO3↓+CO2↑+H2O。(4)实验中获得的若洗涤不充分会含有氯化铵杂质,在焙烧时氯化铵分解会产生污染性气体HCl和NH3。(5)由题给装置图可知,实验通过测定装置E中的增重,确定生成的二氧化碳的质量,再利用n(C)=n(Co)可知CoxOy中Co的物质的量,进而计算Co的质量,装置D管内残留物质是CoxOy,计算出氧元素质量,再计算氧原子的物质的量,根据原子物质的量之比确定化学式。①装置A中制得的O2中含有少量的Cl2,B装置中所盛放的物质用于吸收Cl2,a、饱和NaHCO3溶液可以吸收氯气,但生成二氧化碳,影响二氧化碳质量的测定,错误;b、NaOH溶液可以吸收氯气,氧气的量不变,正确;c.c.KMnO4溶液不能吸收氯气,错误;d.饱和NaCl溶液不能吸收氯气,错误;选b;②E管增重4.40g是二氧化碳的质量,物质的量为0.1mol,根据化学式CoCO3可知,n(Co)=n(C)=0.1mol,Co的质量为0.1mol×59g/mol=5.9g,D管内残留物质的质量8.30g是CoxOy的质量,CoxOy中氧元素质量为8.3g-5.9g=2.4g,氧原子的物质的量n(O)=0.15mol,n(Co):n(O)=0.1mol:0.15mol=2:3,该钴的氧化物的化学式为Co2O3。③缺少F装置,装置E中碱石灰可以吸收空气中水蒸气、二氧化碳,造成二氧化碳质量偏大,进而Co的质量偏大,x/y的值偏大。
本题难度:一般
5、选择题 化学是建立在实验基础上的学科.关于下列各实验装置的叙述中,不正确的是( )
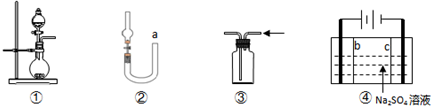
A.装置①可用于实验室制取少量NH3或O2
B.可用从a处加水的方法检验装置②的气密性
C.实验室可用装置③收集H2、NH3
D.利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
参考答案:A、①装置用于固体和液体反应生成气体的装置,实验室制备少量氨气可用浓氨水和生石灰,制备少量氧气和用过氧化氢和二氧化锰来制备,都可以用该装置,故A正确;
B、②从a处加水,如左边液面不发生变化,可证明气密性良好,故B正确;
C、③氢气和氨气的密度都小于空气,可用向下排空气法收集,故C正确;
D、④电解硫酸钠溶液,阴离子向阳极移动,在阳极上生成氧气和硫酸,b应为阴离子交换膜,阳离子向阴极移动,在阴极上生成氢气和氢氧化钠,c应为阳离子交换膜,故D错误.
故选D.
本题解析:
本题难度:一般