微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 若NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.14 g氮气中含有7 NA个电子
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
参考答案:C
本题解析:A不正确,应该是2NA;B中氢气是1mol,含有氢原子数是2NA;氮原子的电子数是7个,14g氮气是0.5mol,含有电子是7NA;NA个一氧化碳分子和0.5 mol甲烷的质量比为28∶8,所以正确的答案选C。
本题难度:一般
2、选择题 设NA代表阿伏加德罗常数的数值,下列说法中正确的是(?)
①常温常压下,17 g重甲基(-14CD3)所含的中子数为11NA;
②常温常压下,22.4 L NO气体的分子数小于NA;
③64 g铜发生氧化还原反应,一定失去2NA个电子;
④室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA;
⑤1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3 NA;
⑥常温常压下,1 mol氦气含有的核外电子数为4NA;
⑦6.8g熔融的KHSO4中含有的阳离子数为0.05 NA;
A.①②
B.③④⑦
C.②④⑦
D.②⑤⑥
参考答案:C
本题解析:①-14CD3的中子数为11,17g含17g÷20g/mol×11<11mol,错;
②常温为25℃,高于标准状况温度,摩尔体积>22.4mol?L?1,所以正确;
③铜与硫反应,铜失1个电子,64 g铜发生氧化还原反应,有可能失去NA个电子;
④乙烯和丁烯的最简式相同,含C原子的物质的量为:21.0g÷14g/mol=1.5mol;
⑤铁原子失去2个电子,所以⑤错误;
⑥氦为单原子分子,1 mol氦气含有的核外电子数为2NA;
⑦熔融的KHSO4中含有的阳离子为K+,则6.8g熔融的KHSO4中含阳离子:
6.8g÷136g/mol=0.05mol。
本题难度:一般
3、选择题 设NA为阿伏加德罗常数,下列说法正确的是(?)
A.1mol Cl2通入水中,充分反应后转移电子数为NA
B.常温下,1.12L NO2气体含分子数为0.05NA
C.1L 0.5mol·L-1碳酸氢钠溶液中含离子数为NA
D.通常状况下16gO2和O3混合气体中含氧原子数为NA
参考答案:D
本题解析:A、Cl2+H2O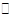 HCl+HClO,反应为可逆反应,有限度的所以Cl2只能部分与水反应,错误;B、标准状况下,1.12L气体的物质的量才是0.05mol,错误;C、溶液中的H2O、HCO3-要发生电离,错误;D、16gO2和O3混合气体相当于16g的O,M(O)=16g/mol,所以含氧原子数为NA,正确。
HCl+HClO,反应为可逆反应,有限度的所以Cl2只能部分与水反应,错误;B、标准状况下,1.12L气体的物质的量才是0.05mol,错误;C、溶液中的H2O、HCO3-要发生电离,错误;D、16gO2和O3混合气体相当于16g的O,M(O)=16g/mol,所以含氧原子数为NA,正确。
本题难度:一般
4、实验题 实验室需用CuSO4·5H2O体配制480mL0.1mol/L的CuSO4溶液,请回答下列问题:
(1)应用托盘天平称取CuSO4·5H2O晶体?_______g。
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上(1g以下使用游码),天平平衡时,实际称量的CuSO4·5H2O晶体是__________g。
(3)本实验用到的主要仪器有:托盘天平、量筒、烧杯、玻璃棒、________、________。
(4)配制过程中有几个关键的步骤和操作如下图所示:将这些实验步骤A—F按实验过程先后次序排
列?。
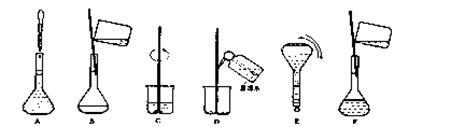
其中定容的具体操作是?。
(5)以下情况会使所配溶液的浓度产生何种影响(A.偏高? B.偏低? C.不变,填序号。):
①溶解晶体用的烧杯和玻璃棒未洗涤:____________;
②定容时俯视刻度线:____________;
③所用CuSO4·5H2O晶体已失去部分结晶水:____________。
参考答案:(1)12.5?(2)11.5?(3)500ml容量瓶?胶头滴管
(4)CBDFAE?其中定容的具体操作是:向容量瓶中加入蒸馏水,到液面离刻度线1~2cm处时,改用胶头滴管加蒸馏水至凹液面最低点与刻度线相切?(5)B;A;A
本题解析:(1)配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml容量瓶。因此需要CuSO4的物质的量n=cV=0.5L×0.1mol?L-1=0.05mol。CuSO4?5H2O的物质的量等于CuSO4的物质的量,所以CuSO4?5H2O的质量=0.05mol×250g/mol=12.5g。
(2)若药品与砝码放反,根据天平平衡原理m(左盘)=m(右盘)+游码读数,故实际称量硫酸铜晶体的质量为12g-0.5g=11.5g。
(3)溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)固体,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀。所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,因此还需要的仪器为:500mL容量瓶、药匙、胶头滴管。
(4)由(3)中溶液配制的一般步骤可知,正确的操作顺序为:CBDFAE。其中定容的具体操作是:向容量瓶中加入蒸馏水,到液面离刻度线1~2cm处时,改用胶头滴管加蒸馏水至凹液面最低点与刻度线相切。
(5)①溶解晶体用的烧杯和玻璃棒未洗涤,少量硫酸铜沾在烧杯壁与玻璃棒上,移入容量瓶内硫酸铜的物质的量减少,所配溶液的浓度偏低,故答案为:B。
②定容时俯视刻度线,液面在刻度线下方,溶液的体积偏小,所配溶液的浓度偏高,故答案为:A。
③所用CuSO4?5H2O晶体已失去部分结晶水,硫酸铜的质量分数增大,实际称量的硫酸铜晶体中硫酸铜的质量偏大,所配溶液的浓度偏,答案选A。
本题难度:一般
5、填空题 (11分)(1)在V L Al2(SO4)3溶液中,测得含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为 ,SO42-的物质的量浓度为 。
(2)在标准状况下,4 g H2、11.2 L O2、1 mL H2O中,所含分子数最多的是 ,含原子数最多的是 ,质量最大的是 ,体积最小的是 。
(3)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为 ,物质的量之比为 ,原子总数之比为 ,质量之比为 ,密度之比为 。
参考答案:(1)a/54Vmol/L;a/18Vmol/L。(2)H2;H2;O2;H2O。
(3)1:1 1:1 5:3 4:11 4:11
本题解析:考查一定物质的量浓度溶液的配制。
(1)Al3+的质量为a g,则铝离子的物质的量是a/27mol,所以根据化学式可知,Al2(SO4)3的物质的量是a/54mol,则硫酸铝的浓度是a/54Vmol/L;根据硫酸铝的化学式可知,SO42-的物质的量浓度为a/54Vmol/L×3/2=a/18Vmol/L。
(2)在标准状况下,4 g H2、11.2 L O2、1 mL H2O的物质的量分别是2mol、0.5mol和1/18mol。所以所含分子数最多的是氢气;含原子数最多的是氢气,含有4mol氢原子;氧气和水的质量分别是16g和1g,所以质量最大的是氧气;而体积最小的是水。(3)
(3)根据阿伏加德罗定律可知,在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为1
本题难度:一般