|
|
|
高考化学试题《物质的分离、提纯》高频试题预测(2017年最新版)(四)
2017-08-26 01:03:00
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (每空3分共计10分)硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
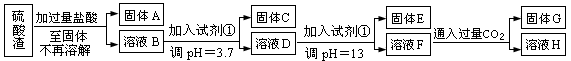
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
A.氢氧化钠
B.氧化铝
C.氨水
D.水
| (3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;(任写一点)
(4)H中溶质的化学式: ;
(5)计算溶液F中c(Mg2+)= (25℃时,氢氧化镁的Ksp=5.6×10-12)
参考答案:(1)SiO2+2NaOH=Na2SiO3+H2O?(2)A
(3)镁离子沉淀不完全或氢氧化铝溶解不完全等?(4)NaHCO3?(5)5.6× 10–10 mol/L
本题解析:(1)硫酸渣中只有二氧化硅和盐酸不反应,所以A是二氧化硅,和氢氧化钠溶液反应的方程式是SiO2+2NaOH=Na2SiO3+H2O。
(2)试剂①的作用是中和溶液中的氢离子,生成氢氧化物沉淀。由于氨水中pH最大只能是11,所以应该选择氢氧化钠,答案选A。
(3)根据流程图可知,固体C是氢氧化铁,E是氢氧化镁,所以如果氢氧化钠不足,则镁离子沉淀不完全,且氢氧化铝溶解也不完全。
(4)溶液F是氢氧化钠和偏铝酸钠的混合物,所以通入足量的CO2是生成沉淀氢氧化铝,而溶液中的溶质则是碳酸氢钠。
(5)溶液中OH-浓度是0.1mol/L,所以根据溶度积常数可知,溶液中c(Mg2+)=5.6×10-12÷0.12=5.6× 10–10 mol/L。
本题难度:一般
2、选择题 “酸化”是实验中经常采用的方法,下列说法正确的是
A.提高高锰酸钾的氧化能力,用浓盐酸酸化
B.抑制Fe2+的水解,用稀硝酸酸化
C.检验某卤代烃中是否含氯元素,先加HNO3酸化,再加AgNO3溶液检验
D.确认溶液中含有SO42-时,先用盐酸酸化,再加BaCl2溶液检验
参考答案:D
本题解析:A、盐酸能被高锰酸钾氧化,应用硫酸酸化,错误;B、稀硝酸具有强氧化性,能氧化Fe2+,错误;C、卤代烃中的卤原子需在碱性条件下水解,产生卤素离子,否则不能,错误;D、先排除碳酸根离子、亚硫酸根离子、银离子干扰,正确。
本题难度:一般
3、选择题 下列溶液中,溶质的物质的量浓度为1mol?L-1?的是
A.将40?g?NaOH溶于1?L?水所得的溶液
B.将5?mol?L-1的H2SO4溶液100ml稀释成500ml
C.NA个氯化氢分子溶于水配成1L溶液
D.c(K+)为1?mol?L-1的K2SO4溶液
参考答案:BC
本题解析:分析:A.40gNaOH的物质的量为1mol,溶于水配成1L溶液浓度为1mol?L-1;
B.根据n=cv解题;
C.NA个氯化氢分子物质的量是1mol;
D.根据硫酸钾的化学式可知钾离子浓度为硫酸钾浓度的2倍.
解答:A.40gNaOH的物质的量为1mol,溶于水配成1L溶液浓度为1mol?L-1,不是溶剂的体积为1L,故A错误;
B.根据n=cv=5?mol?L-1×0.1L=0.5mol,溶液的体积是0.5L,所以溶液浓度为1mol/L,故B正确;
C.NA个氯化氢分子物质的量是1mol,溶于水配成1L溶液浓度为1mol/L,故C正确;
D.钾离子浓度为硫酸钾浓度的2倍,含K+为1mol?L-1的K2SO4溶液浓度为0.5mol/L,故D错误.
故选BC.
点评:本题考查物质的量浓度的理解与计算,难度较小,注意物质的量浓度中体积指溶液体积,物质溶于水溶质变化的情况.
本题难度:一般
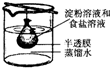
4、选择题 将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图所示),2min后分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
A.袋内液体加入硝酸银溶液后无变化
B.烧杯内液体加入碘水后呈蓝色
C.袋内液体加入碘水后不变蓝
D.烧杯内液体加入硝酸银溶液后有白色沉淀产生
|
参考答案:D
本题解析:
本题难度:简单
5、选择题 欲使NaCl、NH4Cl和SiO2的混合物分开,其必要的操作为
A.升华、溶解、过滤、蒸发
B.溶解、过滤、蒸发、分液
C.加热、溶解、过滤、结晶
D.溶解、过滤、分馏、结晶
参考答案:C
本题解析:NaCl溶于水、NH4Cl受热易分解、SiO2不溶于水,因此C正确。
本题难度:简单
