微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,说法不正确的是( )
A.复分解反应一定都不属于氧化还原反应
B.在氧化还原反应中,金属单质一定不是氧化剂
C.在氧化还原反应中,非金属单质一定是氧化剂
D.置换反应一定都属于氧化还原反应
参考答案:A.复分解反应中一定没有元素的化合价变化,则复分解反应一定都不属于氧化还原反应,故A正确;
B.金属单质在反应中元素的化合价一定升高,一定为还原剂,则在氧化还原反应中,金属单质一定不是氧化剂,故B正确;
C.非金属单质在反应中元素的化合价可能升高,也可能降低,如氢气与氯气反应时H元素的化合价升高,为还原剂,则在氧化还原反应中,非金属单质不一定是氧化剂,故C错误;
D.置换反应中一定存在元素的化合价变化,则置换反应一定都属于氧化还原反应,故D正确;
故选C.
本题解析:
本题难度:简单
2、选择题 在下列反应中,水既不是氧化剂又不是还原剂的是( )
A.F2+H2O(生成O2和HF)
B.Na+H2O
C.NaH+H2O(生成H2和NaOH)
D.Na2O2+H2O
参考答案:D
本题解析:
本题难度:简单
3、填空题 将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下:
2FeCl3+Cu═2FeCl2+CuCl2
(1)请用双线桥法标出电子转移的方向和数目.
(2)在该反应中,氧化剂是______,氧化产物是______.
(3)当有0.3mol电子发生转移时,发生反应的Cu的质量为______g.
(4)请将以上反应改写为离子方程式______.
参考答案:(1)化合价升高元素是Cu,失电子,化合价降低元素是Fe,得到电子,化合价升高数=化合价降低数=转移电子数=2,双线桥法,电子转移的方向和数目如下:
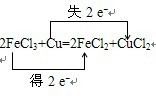
,故答案为:

;
(2)化合价降低元素Fe元素所在的反应物FeCl3是氧化剂,对应产物FeCl2是还原产物,化合价升高元素Cu所在的反应物是还原剂,对应产物CuCl2 是氧化产物,故答案为:FeCl3;CuCl2;
(3)根据方程式当有2mol电子发生转移时,发生反应的Cu的物质的量是1mol,当有0.3mol电子发生转移时,发生反应的
Cu的物质的量是0.15mol,质量是0.15mol×64g/mol=9.6g,故答案为:9.6;
(4)反应2FeCl3+Cu=2FeCl2+CuCl2改为离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+.
本题解析:
本题难度:一般
4、简答题 “比较”是化学研究的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应.
如:2Na2O+2CO2═2Na2CO3+O2,Na2O2+CO═Na2CO3
(1)试分别写出Na2O2与SO2、Na2O2与SO3(g)反应的化学方程式:______、______
(2)当1mol?SO3(g)参加反应时,转移电子的物质的量为______mol.
(3)通过比较可知:在氧化物中,当非金属元素处于______(填“最低”、“中间”或“最高”)价时,其氧化物与过氧化钠反应就有O2生成.
参考答案:(1)根据根据过氧化钠和二氧化碳的反应,可以推知过氧化钠和二氧化硫反应生成亚硫酸钠和氧气,亚硫酸钠易被氧气氧化为硫酸钠,即SO2+Na2O2=Na2SO4,三氧化硫和过氧化钠反应生成硫酸钠和氧气,
即2SO3+2Na2O2=2Na2SO4+O2,故答案为:2Na2O2+2SO2═2Na2SO4;2Na2O2+2SO3═2Na2SO4+O2;
(2)根据反应2Na2O2+2SO3═2Na2SO4+O2,该反应中化合价升高值=化合价降低值=2,即转移电子数为2,
所以当1mol?SO3(g)参加反应时,转移电子的物质的量为1mol,故答案为:1;
(3)根据反应2Na2O+2CO2═2Na2CO3+O2,Na2O2+CO═Na2CO3和2Na2O2+2SO2═2Na2SO4,2Na2O2+2SO3═2Na2SO4+O2,比较可知:在氧化物中,当非金属元素处于最高价时,其氧化物与过氧化钠反应就有O2生成,故答案为:最高.
本题解析:
本题难度:一般
5、选择题 科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类化合物.下列说法不正确的是( )
A.维生素C具有还原性
B.上述过程中砷元素发生还原反应
C.因为虾类等水生甲壳类动物中含有砷元素,所以不能食用
D.+5价砷转化为+3价砷时,失去电子
参考答案:A、食用虾类等水生甲壳类动物中含有+5价砷类物质,与维生素C反应生成+3价砷类化合物,则维生素C具有还原性,故A正确;
B、上述过程中砷元素化合价降低,发生还原反应,故B正确;
C、虾类等水生甲壳类动物中含有+5价砷类物质,无毒,但+3价砷类化合物有毒,故C错误;
D、+5价砷转化为+3价砷时,化合价降低,得到电子,故D错误.
故选CD.
本题解析:
本题难度:一般