微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应式为:4Al + 3O2 +6H2O ===4Al(OH)3下列说法不正确的是( )
A.电池工作时,电流由铝电极沿导线流向铂电极
B.正极反应式为:O2 + 2H2O +4e-=== 4OH-
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
参考答案:A
本题解析:根据化学方程式可知,单质Al失去电子,作还原剂,氧气得到电子,作氧化剂。所以铝是负极,铂电极是正极,氧气在正极得到电子。因此电池工作时,电流由铂电极沿导线流向铝电极,选项A不正确,其余选项都是正确的,答案选A。
点评:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,据此可以进行有关的判断和电极反应式的书写。
本题难度:一般
2、简答题 (1)原电池反应通常是放热反应,下列化学反应在理论上可设计成原电池是______,理由是______.
A.C(s)+H2O(g)=CO(g)+H2(g)△H>O
B.C(s)+CO2(g)=2CO(g)△H>O
C.CaC2(s)+2H2O?(g)=Ca(OH)2(l)+C2H2(g)△H<O
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H<O
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计一个原电池,其负极反应式为______;
以H2SO4溶液为电解质溶液,将(1)中D选项的CH4改为C6H12O6,其负极反应式为______.
(3)电解原理在化工上有着广泛的应用,现将你设计的原电池通过导线与右图中的电解池相连,其中a为电解质溶液,X和Y为两块电极板,则:
①若X和Y均为惰性电极,a为饱和的NaCl溶液,则检验Y电极产物的方法是______;
②若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则阳极反应式为______;
③若X和Y均为惰性电极,a为CuSO4溶液,电解一段时间后,向所得溶液中加入0.1mol的Cu(OH)2,恰好使溶液恢复电解前的浓度和PH,则电解过程中阳极产生的气体体积(标况下)为______.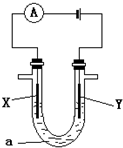
参考答案:(1)能构成原电池的条件之一是:该反应是放热反应,即△H<O,且该反应必须是能自发进行的氧化还原反应.
A、该反应是吸热反应,故错误.
B、该反应是吸热反应,故错误.
C、该反应不是氧化还原反应,故错误.
D、该反应是放热反应且是能自发进行的氧化还原反应,故正确.
故答案为:D;理由是:该反应既是放热反应,又是自发的氧化还原反应.
(2)碱性条件下,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH--8e=CO32-+7H2O;
酸性条件下,C6H12O6失电子和水反应生成二氧化碳和氢离子,电极反应式为?C6H12O6-24e+6H2O=6CO2+24H+.
故答案为:CH4+10OH--8e=CO32-+7H2O;?C6H12O6-24e+6H2O=6CO2+24H+.
(3)①当石墨作电极时,阳极Y上氯离子失电子生成氯气,氯气有氧化性能和碘离子发生置换反应生成碘单质,淀粉遇碘变蓝色,所以检验氯气的方法是将湿润的淀粉KI试纸靠近Y极支管口处,试纸变蓝,说明有氯气生成.
故答案为:将湿润的淀粉KI试纸靠近Y极支管口处,试纸变蓝,说明有氯气生成.
②当较活泼的金属铁作阳极时,金属铁失电子生成二价铁离子,电极反应式为Fe-2e=Fe 2+.
故答案为Fe-2e=Fe 2+.
③根据“电解出什么物质加入什么物质”的方法知,加入Cu(OH)2相当于加入CuO.H2O,所以发生电解时分两段,一段是生成氧气和铜,一段是生成氢气和氧气.
当生成氧气和铜时,根据原子守恒知:0.1mol的Cu(OH)2相当于有0.1molCuO,所以生成0.05mol氧气;
0.1mol的Cu(OH)2相当于有0.1molH2O,电解0.1mol水生成0.05mol氧气.
所以阳极上产生的氧气的体积=(0.05+0.05)mol×22.4L/mol=2.24L.
故答案为:2.24L.
本题解析:
本题难度:一般
3、选择题 在理论上不能用于设计原电池的化学反应是?
A.NaCl(aq)+ AgNO3(aq)= AgCl(s)+ NaNO3(aq )△H<0
B.2CH3OH (l) +3O2(g) = 2CO2(g) + 4H2O (l)△H<0
C.2FeCl3(aq)+Fe(s) = 3FeCl3(aq)△H < 0
D.2H2 (g) + O2 (g) = 2H2O (l)△H < 0
参考答案:A
本题解析:只有在氧化还原反应中才有电子的得失,因此只有氧化还原反应才能设计成原电池,据此可知选项BCD都是可以设计成原电池的。选项A中反应是复分解反应,不是氧化还原反应,不能设计成原电池,答案选A。
点评:该题是基础性试题的考查,主要是考查学生对原电池原理的熟悉了解程度,意在培养学生的逻辑推理能力。该题的关键是明确原电池的工作原理,然后结合具体的化学方程式灵活运用即可。
本题难度:一般
4、选择题 一种充电池放电时的电极反应为H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH-,当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A.H2O的还原
B.Ni(OH)2的还原
C.H2的氧化
D.Ni(OH)2的氧化
参考答案:充电池放电时发生NiO(OH)+H2O+e-=Ni(OH)2+OH-,应为原电池的正极反应,NiO(OH)是氧化剂被还原,则充电时NiO(OH)是氧化产物,与正极相连的是阳极发生氧化反应,则Ni(OH)2被氧化,
故选D.
本题解析:
本题难度:简单
5、选择题 下列关于下图装置的说法正确的是

[? ]
A.银电极是负极
B.铜电极上发生的反应为Cu-2e-=Cu2+
C.外电路中的电子是从银电极流向铜电极
D.该装置能将电能转化为化学能
参考答案:B
本题解析:
本题难度:一般