微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氢氧燃料电池是将氢和氧分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应为:2H2 +4OH- - 2e-=4H2O和O2 +2H2O+ 2e-=4OH-,则下列叙述正确的是
[? ]
A.通入H2的一极是正极,通入O2的一极是负极
B.通入O2的一极是正极,通入H2的一极是负极
C.电池工作一段时间后,电解质溶液的pH增大
D.电池在工作时,负极区附近的pH增大
参考答案:B
本题解析:
本题难度:一般
2、填空题 (6分) 由A、B、C、D四种金属按下表中装置进行实验,根据实验现象回答①②③
参考答案:(6分)?2H+ +2e--==?H2↑;C→B;D>A>B>C
本题解析:金属A不断溶解,说明A是负极,失去电子,发生氧化反应,则A的金属性强于B的。其中正极是氢离子放电生成氢气,电极反应式是2H+ +2e--==?H2↑;C的质量增加,这说明C是正极,溶液中的铜离子放电,生成铜而形成,则电流方向是C→B,其中B的金属性强于C的;A和D构成原电池时,A上有气体产生,说明A是正极,溶液中的氢离子放电生成氢气,所以D的金属性强于A的。综上所述,四种金属的金属性强弱顺序是D>A>B>C。
点评:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,据此可以进行有关的判断。
本题难度:一般
3、填空题 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,b电极变粗,且在c、d电极有气体产生,两极上共收集到336mL(标准状态)气体.回答:
(1)直流电源中,M为______极.
(2)Pt电极上生成的物质是______,其质量为______g.
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2:______:______:______.
(4)AgNO3溶液的浓度______(填“增大”、“减小”或“不变”.下同),AgNO3溶液的pH______,H2SO4溶液的浓度______,H2SO4溶液的pH______.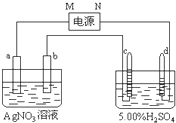
参考答案:(1)根据题意知,电极a、b上没有气体生成,则a作阳极,b为阴极,所以M是原电池正极,故答案为:正;
(2)电解稀硫酸反应时,当通电一段时间后,c、d两极共收集到336mL气体(标准状况),则阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,电池反应式为:2H2O?电解?.?2H2↑+O2↑,根据方程式知,生成氢气的体积占总体积的23所以混合气体中氢气的体积是224mL,根据2H++2e-═H2↑知,转移电子的物质的量是0.02mol,串联电解池中转移电子数相等,电镀池阴极上析出银的质量为
Ag++e-=Ag
?1mol 108g?
0.02mol?2.16g
故答案为:银;2.16g;
(3)b电极上的电极反应式为:Ag++e-=Ag
C.电极上的电极反应式为:4OH--4e-=2H2O+O2↑
d.电极上的电极反应式为:2H++2e-=H2↑
假设转移电子的物质的量是2mol,则生成银2mol、生成氧气0.5mol、生成氢气1mol,所以
所以电子的物质的量与电极b、c、d分别生成的物质的物质的量之比为:2:2:0.5:1,
故答案为:2;0.5;1;
(4)在铂电极上镀银时,阳极上的电极反应式为Ag-e-=Ag+,阴极上的电极反应式为Ag++e-=Ag,所以硝酸银溶液的浓度不变,溶液的pH不变;电解稀硫酸溶液时,阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,溶液中的溶质不变,溶剂减少,导致稀硫酸的浓度增大,溶液的pH值减小;
故答案为:不变;不变;增大;减小.
本题解析:
本题难度:一般
4、选择题 下图为铜锌原电池示意图,下列说法正确的是
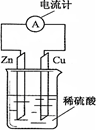
A.电子由铜片通过导线流向锌片
B.烧杯中溶液逐渐呈蓝色
C.锌片逐渐溶解
D.该装置能将电能转变为化学能
参考答案:C
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,则根据装置图可知,锌是负极,失去电子;铜是正极,溶液中的氢离子在正极得到电子,发生还原反应生成氢气。原电池是将化学能转化为电能的装置,所以正确的答案选C。
点评:该题是高考中的常见考点,属于基础性试题的考查。该题的关键是明确原电池的工作原理,然后结合题意和装置图灵活运用即可,有利于培养学生的逻辑推理能力。
本题难度:简单
5、实验题 (15分)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O
(B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)(A) (B) 。
(2)如果(A或B)不能,说明其原因 。
(3)如果(A或B)可以,则写出正、负极材料及其电极反应式,电解质溶液
负极: ; 。
正极: ; 。
电解质溶液: 。
参考答案:(1)(A)不能(1分) (B)能 (1分)
(2)A反应是非氧化还原反应 (2分)
(3)负极:Cu(2分):Cu-2e-=Cu2+(2分)
正极:石墨(2分,其它合理答案亦可):2Fe3++2e-=2Fe2+(3分)
电解质溶液:氯化铁溶液(2分)
本题解析:(1)由于电子的定向运动形成电流,所以只有氧化还原反应才能设计成原电池,A是中和反应,表示氧化还原反应,不能设计成有点像。B是氧化还原反应,可以。
(3)根据B的总反应式可知,铜失去电子,作还原剂,所以作原电池的负极。正极材料只用金属性弱于铜即可。氯化铁得到电子 91ExAm.org,因此电解质溶液是氯化铁。
本题难度:一般