微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 【化学——选修:物质结构与性质】( 15分)
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
?
| A
| B
| C
| D
| E
| F
|
主要化合价
| -1
| -3 +5
| -2?+6
| -1?+7
| +2
| +1?+2
|
原子半径nm
| 0.071
| 0.11
| 0.102
| 0.099
| 0.197
| 0.117
|
请回答下列问题:
(1)B、C、D三种元素第一电离能数值由小到大的顺序是?(填元素符号);
(2)B的氢化物中心原子采取?杂化,空间构型是?形,是?分子
(填“极性”或“非极性”);
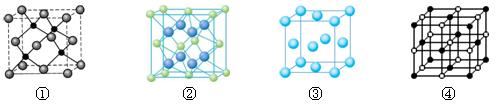
(3)F2+与NH3 形成配离子的化学式为?,F单质晶体晶胞是下图的?
(填①、②、③或④);
(4)A 、E两种元素形成晶体晶胞是下图中的?(填①、②、③或④),A离子的配位数是?;
(5)右图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,
请选出C的氢化物所在的折线?(填n、m、x或y)。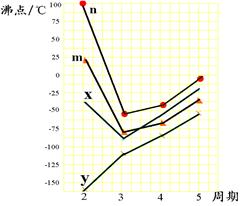
参考答案:(1)S<P<Cl?(2分)
(2)Sp3 ?(1分)?三角锥(1分)?极性(1分)
(3)[Cu(NH3)4]2+(2分)?③?(2分)
(4)②(2分)? 4?(2分)
(5) n?((2分)
本题解析:略
本题难度:一般
2、填空题 (13分)A、B、C、D、E、F都是短周期主族元素,教育博客原子系数依次增大。其中B原子最外层上的电子数是其电子层数的2倍;教育博客A能和C形成原子个数比为1:1和2:1的物质;D也能和C形成原子个数比为1:1和2:1的物质;D、E、F元素的最高价氧化物的水化物两两皆能反应,都生成盐和水;F单质在常温下是一种气体。试回答:
(1)请写出下列元素的名称: C______,E_______, F______,
B在元素周期表中的位置是________________。
(2)B、C、F三种元素形成的氢化物中,沸点最高的是________________。(填分子式)
(3)A与C形成的含有18个电子的分子的电子式是_____________。
(4)C、 D单质形成原子个数比为1:1的化合物的化学方程式是_______________。
(5)E单质与D元素最高价氧化物的水化物反应的离子方程式是______________。
参考答案:(13分)(1)氧?铝?氯?(写符号无分 (每个1分)
第二周期IVA 族?(2分)
(2)H2O?(2分)
(3)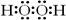 ?(2分)
?(2分)
(4)2Na+O2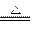 2Na2O2?(无条件扣1分)(2分)
2Na2O2?(无条件扣1分)(2分)
(5)2Al + 2OH- + 2H2O ="=" 2AlO2- + 3H2↑ (2分)
本题解析:略
本题难度:简单
3、选择题 最外层有2个电子的主族元素X与最外层有7个电子的另一主族元素Y化合,以下有关描述错误的是( )
A.X与Y可形成XY2型离子化合物
B.在XY2中X的原子半径比Y原子半径大
C.在形成化合物XY2时,X元素被氧化而Y元素被还原
D.生成化合物一定溶于水
参考答案:BD
本题解析:X的一个原子失去两个电子变成X2+,Y的一个原子获得一个电子变成Y-,二者相互作用可形成XY2型离子化合物;A项正确,不是答案。在XY2型离子化合物中,X的原子半径不一定比Y的半径大,如MgBr2中,镁离子的半径就小于溴离子半径;B项不正确。在形成化合物XY2时,X元素的原子失去电子被氧化,而Y元素的原子得到电子被还原;C项正确,不是答案。离子化合物不一定都溶于水,如CaF2就不溶于水,D不正确。本题要求找出错误的描述,故B、D应为答案。
本题难度:一般
4、选择题 主族元素在周期表中的位置取决于该元素原子的( )。
A.相对原子质量和核外电子数
B.电子层数和最外层电子数
C.相对原子质量和最外层电子数
D.电子层数和次外层电子数
参考答案:B
本题解析:主族元素最外层电子数决定了在元素周期表中的主族序数,电子层数决定了周期序数。
本题难度:简单
5、填空题
Ⅰ.请按下列要求写出相应粒子的电子排布式,并回答有关问题:
⑴写出基态原子或离子的电子排布式:
①Fe3+_________________; ②Cr _______________; ③Cu _______________.
⑵比较 Fe2+与Fe3+的化学稳定性:Fe2+?Fe3+,半径大小:Fe2+?Fe3+
Ⅱ⑴在第三周期中,第一电离能最小的元素是________,电负性最大的元素是________(用元素符号表示)。
⑵第二、三、周期原子中p轨道半充满的元素是_______?(用元素符号表示)。
⑶第二周期原子中,未成对电子数等于周期系数的原子有?(用元素符号表示)
Ⅲ. (2010·滁州模拟)ClO、ClO、ClO中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构。
微粒
| ClO
| ClO
| ClO
|
立体结构
| ?
| ?
| ?
参考答案:(14分)Ⅰ. ⑴1s22s22p63s23p63d5、1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1。
⑵Fe2+< Fe3+;Fe2+> Fe3+
Ⅱ①Na;Cl?②N;P?③C;O
Ⅲ.
微粒
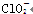
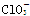
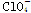
立体结构
V形
三角锥形
正四面体
本题解析:Ⅰ.(1)根据构造原理可知Fe3+、Cr、Cu的核外电子排布式分别是1s22s22p63s23p63d5、1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1。
(2)由于铁离子中3d轨道电子处于半充满状态,稳定性强,所以稳定性是Fe2+< Fe3+;而微粒半径则是Fe2+> Fe3+。
Ⅱ⑴金属性越小第一电离能越小,非金属性越强,电负性越大。所以在第三周期中,第一电离能最小的元素是Na,电负性最大的元素是Cl。
⑵根据元素的核外电子排布式可知,第二、三、周期原子中p轨道半充满的元素是N和P。
⑶同样根据元素的核外电子排布式可知,第二周期原子中,未成对电子数等于周期系数的原子有C和O。
Ⅲ.根据价层电子对互斥理论可知,ClO、ClO、ClO中中心原子氯原子含有的孤对电子对数分别是(7+1-2×2)÷2=2、(7+1-3×2)÷2=1、(7-1-4×2)÷2=0,所以微粒的空间构型分别是V形、三角锥形和正四面体型。
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是熟练记住构造原理以及价层电子对互斥理论,然后结合题意灵活运用即可,有利于培养学生的逻辑推理和抽象思维能力,提高学生的应试能力和学习效率。
本题难度:一般
|