微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 如图所示,以石墨为电极电解A的水溶液,并做下面一系列实验。试根据实验现象完成下列问题(电解质A的水溶液焰色反应呈紫色)。?
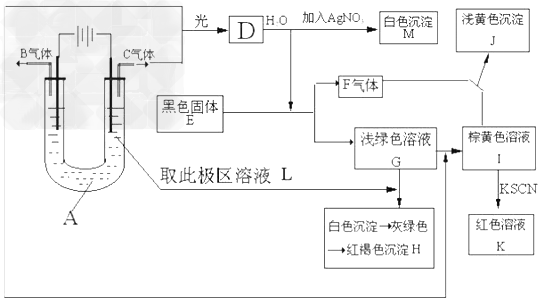
(1)A的化学式为__________,E的名称为____________
(2)I和F反应的离子方程式是____________。
(3)若将电解装置中的阳极换成铁棒,则在U型管底部可观察到的现象是______________,电解的化学方程式为______________。
参考答案:(1)KCl;?硫化亚铁?
(2)2Fe3+?+?H2S==2Fe2+?+?S↓+?2H+
(3)产生了白色絮状沉淀,变成灰绿,后变成红褐色。?Fe+2H2O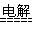 Fe(OH)2↓+H2?↑
Fe(OH)2↓+H2?↑
本题解析:
本题难度:一般
2、填空题 (6分)除去下列物质中的杂质(括号中的物质为杂质),请填表中空白处:
物质
| 加入试剂
| 离子方程式
|
KCl(K2CO3)
| .
| ?
|
FeCl3(FeCl2)溶液科
| [
| ?
|
FeSO4 (CuSO4) 溶液
| ?
| ?
参考答案:HCl? 2H++CO32- =H2O + CO2?或? CaCl2? ...
?Cl2?2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
?Fe? Fe + Cu2+ = Fe2+ + Cu
本题解析:略
本题难度:一般
3、简答题 在实验室里制取的乙烯中常混有少量二氧化硫.某化学课外小组设计了如图所示实验,以确认上述混合气体中含有乙烯和二氧化硫.请填写下列空白:
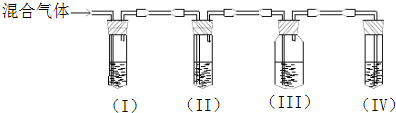
(1)能说明SO2气体存在的现象是______.
(2)使用装置Ⅱ的目的是______;有关反应的离子方程式是______.
(3)使用装置Ⅲ的目的是______.
(4)确定含有乙烯的现象是______;乙烯与溴水反应的化学方程式为______.
参考答案:乙烯不与NaOH溶液反应,但二氧化硫能与碱反应(SO2+2NaOH=Na2SO3+H2O),二氧化硫是否存在可用品红溶液检验.乙烯的检验应放在排除SO2的干扰后进行,选通过品红溶液褪色检验SO2的存在;再通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净.最后用高锰酸钾酸性溶液褪色实验检验乙烯;
(1)二氧化硫是否存在可用品红溶液检验,品红溶液褪色说明含有二氧化硫,
故答案为:装置Ⅰ中品红溶液褪色;
(2)乙烯和二氧化硫都能使溴水或高锰酸钾酸性溶液褪色,二氧化硫的存在影响乙烯的检验,故检验乙烯时应先除去二氧化硫,有关反应的离子方程式是SO2+Br2+H2O═4H++SO42-+2Br-,
故答案为:除去二氧化硫气体,以免干扰乙烯的实验,SO2+Br2+H2O═4H++SO42-+2Br-;
(3)通过NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,
故答案为:检验二氧化硫是否除尽;
(4)最后用高锰酸钾酸性溶液褪色实验检验乙烯,装置Ⅳ中的酸性高锰酸钾溶液褪色,说明含有乙烯;乙烯与溴水发生加成反应的方程式:CH2=CH2+Br2→CH2BrCH2Br
故答案为:装置Ⅲ中的品红溶液不褪色,装置Ⅳ中的酸性高锰酸钾溶液褪色,CH2=CH2+Br2→CH2Br-CH2Br.
本题解析:
本题难度:一般
4、选择题 下列结论正确的是?(?)
参考答案:D
本题解析:略
本题难度:一般
5、选择题 用过量的H2SO4、NaOH、NH3?H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①、②、③、④是( )
A.①NaCl②NaOH③NH3?H2O④H2SO4
B.①H2SO4②NaOH③NH3?H2O④NaCl
C.①H2SO4②NH3?H2O③NaOH④NaCl
D.①NaCl②NH3?H2O③NaOH④H2SO4
|

参考答案:从题目所给的图示步骤综合分析,可以看出第①步分离五种离子中的一种离子,只能是Ag+与Cl-结合生成AgCl沉淀.第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3?H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离.第④步用SO42-将Ba2+和K+分离,
故选D.
本题解析:
本题难度:一般