微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度时,将1molA和2molB放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)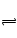 C(g)+2D(g),经5min后,测得容器内B物质的浓度减少了0.2mol·L-1。下列叙述不正确的是 (? )
C(g)+2D(g),经5min后,测得容器内B物质的浓度减少了0.2mol·L-1。下列叙述不正确的是 (? )
A.在5min内该反应用C的浓度变化表示的反应速率为0.02mol·L-1·min-1
B.在5 min时,容器内D的浓度为0.2mol·L-1
C.该反应随着反应的进行,容器内压强逐渐增大
D.5min时容器内气体总的物质的量为3mol
参考答案:D
本题解析:经5min后,测得容器内B物质的浓度减少了0.2mol·L-1,则B物质的反应速率是0.2mol/L÷5min=0.04mol/(L·min)。又因为反应速率之比是相应的化学计量数之比,所以C和D物质表示的反应速率分别是0.02mol/(L·min)、0.04mol/(L·min)。因此在5 min时,容器内D的浓度为0.2mol/L。根据反应方程式可知,该反应是体积增大的,所以压强是增大的。5min时容器内气体总的物质的量为1mol+0.5mol+1mol=2.5mol,所以选项D不正确,其余都是正确的,答案选D。
本题难度:简单
2、选择题 将1mol N2和3 mol H2通入4L的密闭容器中反 应,半分钟后测得H2的物质的量为2.1 mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率:
① v(H2) =" 0.45" mol/(L·min) ② v(N2) =" 1.05" mol/(L·min) ③ v(NH3) =" 0.30" mol/(L·min) 其中正确的是
A.①②
B.②③
C.①③
D.①②③