微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 用菱锌矿(主要成分为碳酸锌,还含有Fe2+、Fe3+、 Mg2+、 Ca2+、Cu2+等)制备氯化锌的一种流程如下:

(1)在反应3前要将菱锌矿研磨,其目的是_______________________________
(2)反应4将Fe2+氧化为Fe3+,该反应的离子方程式为______________________
(3)加入氧化锌调节pH=4.5,反应5的离子方程式为________________________
(4)锌粉不在反应4之前加的原因是____________________________________
(5)若用石墨作电极电解滤液Y,则可以得到参与本流程反应的物质有_________
参考答案:(15分)
(1)增大反应物接触面积,加快反应3的反应速率
(2)2Fe2+ + ClO- + 2H+ =" 2" Fe3+ + Cl- + H2O
(3)ZnO + 2H+ = Zn2+ + H2O 、Fe3+ + 3H2O  Fe(OH)3+ 3 H+
Fe(OH)3+ 3 H+
或3 ZnO + 2 Fe3+ + 3H2O = Fe(OH)3↓ + 3 Zn2+
(4)Zn和H+以及Fe3+反应,将增加Zn的用量以及后续实验中次氯酸钠(或氯酸钠)的用量
(5)H2、Cl2、Zn
本题解析:
(1)依据影响化学反应速率的因素分析判断,增大接触面积会增大反应速率,故答案为:增大反应物接触面积,使反应3反应速率加快;
(2)反应1是氯气与氢氧化钠溶液反应,产物是NaClO、NaClO3和水,反应3中加入了过量盐酸,反应4中将Fe2+氧化为Fe3+,反应的离子方程式为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O,
(3)加入氧化锌调节溶液的pH=4.5,同时得到红褐色沉淀Fe(OH)3,同时不引入新的杂质;反应的离子方程式为:ZnO+2H+═Zn2++H2O,Fe3++3H2O?Fe(OH)3↓+3H+,
(4)因为菱锌矿中含有杂质离子Fe3+,以及加入的盐酸均可以与锌粉反应,这样锌的用量增加,并造成后续反应中所用的次氯酸钠或氯酸钠的用量也增加,
(5)滤液Y是ZnCl2,用石墨作电极,电解时首先得到H2和Cl2,当ZnCl2浓度较大时还可以得到Zn,故答案为:H2、Cl2、Zn。
考点定位:本题考查了物质制备流程的分析判断,影响化学反应速率的因素,难溶电解质的溶解平衡及沉淀转化的本质,常见金属元素的单质及其化合物的综合应用。离子方程式书写,电解原理的应用,题目难度中等。
本题难度:一般
2、选择题 NaCl是海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料的产品(或物质)是( )。
①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸
A.①②③④⑤
B.①②③④
C.①②③⑤
D.①②④⑤
参考答案:A
本题解析:在氯碱工业中,2NaCl+2H2O 2NaOH+H2↑+Cl2↑,H2与Cl2化合被水吸收可得盐酸。2NaCl(熔融)
2NaOH+H2↑+Cl2↑,H2与Cl2化合被水吸收可得盐酸。2NaCl(熔融) 2Na+Cl2↑。在制纯碱工业中主要利用如下原理:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;2NaHCO3
2Na+Cl2↑。在制纯碱工业中主要利用如下原理:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
本题难度:一般
3、选择题 2010年lO月1日,我国成功地发射了嫦娥二号探月卫星,标志着我国探月工程进入崭新阶段.月球的矿产资源极为丰富,仅月球表面5cm厚的沙土就含有铁单质上亿吨,月球上的主要矿物有辉石(CaMgSi2O6)、斜长石(KAlSi3O8)等,下列说法或分析错误的是( )
A.辉石、斜长石均属于硅酸盐矿
B.从辉石的化学式来看,它可被看作为复盐
C.斜长石的氧化物形式可表示为:K2O?Al2O3?6SiO2
D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱科
参考答案:D
本题解析:
本题难度:一般
4、填空题 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
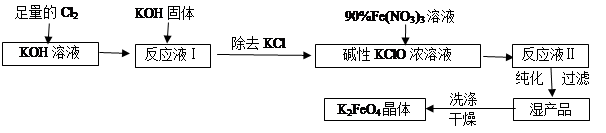
已知:①2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
②6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
(1)该生产工艺应在?(填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式?;
(3)在“反应液I”中加KOH固体的目的是?:
(4)加入硝酸铁溶液生成反应液Ⅱ的化学方程式:?
(5)从“反应液Ⅱ”中分离出K2FeO4后,会有副产品?(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途?。
(6)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图。该实验的目的是?;发生反应的△H?0(填“>”、“<”或“=”)。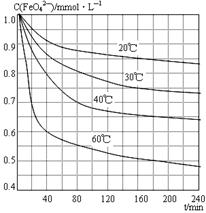
参考答案:温度较低?(2)2NaCl+2H2O Cl2↑+H2↑+2NaOH(3)与“反应液I”中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。(4)2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O(5)KNO3? KCl。KNO3是一种复合化肥。(6)研究温度对c(FeO42-)(或FeO42-水解反应)的影响?>。
Cl2↑+H2↑+2NaOH(3)与“反应液I”中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。(4)2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O(5)KNO3? KCl。KNO3是一种复合化肥。(6)研究温度对c(FeO42-)(或FeO42-水解反应)的影响?>。
本题解析:(1)在温度较低下发生反应① 2KOH + Cl2 =" KCl" + KClO + H2O,在温度较高时发生反应②6KOH+ 3Cl2 =" 5KCl" + KClO3 + 3H2O。现在要制备KClO。为了防止产生杂质KClO3。所以反应要在温度较低下进行。(2)在工业上Cl2是用电解饱和食盐水的方法制取的,反应的化学方程式是2NaCl+2H2O Cl2↑+H2↑+2NaOH。(3)在“反应液I”中要加KOH固体,目的是与反应液I中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。4)加入硝酸铁溶液发生反应的化学方程式:2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O。(5)由反应方程式可看出:分离出K2FeO4后,会得到副产品KNO3? KCl,它们都是重要的化工产品,其中KNO3 KNO3是一种复合化肥。用于农业生产,来达到增产、增收的目的。KCl可用于治疗糖尿病患者或高血压患者的的食用盐的添加剂等。(6)由图可看出:该实验的目的研究温度对c(FeO42-)(或FeO42-水解反应)的影响 。升高温度c(FeO42-)降低。说明升高温度,水解平衡向消耗该物质的方向移动。即升高温度,催进盐的水解。所以水解反应是吸热反应。故△H>0。2FeO4)的生产工艺及制取过程中涉及的化学反应原理的知识。
Cl2↑+H2↑+2NaOH。(3)在“反应液I”中要加KOH固体,目的是与反应液I中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。4)加入硝酸铁溶液发生反应的化学方程式:2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O。(5)由反应方程式可看出:分离出K2FeO4后,会得到副产品KNO3? KCl,它们都是重要的化工产品,其中KNO3 KNO3是一种复合化肥。用于农业生产,来达到增产、增收的目的。KCl可用于治疗糖尿病患者或高血压患者的的食用盐的添加剂等。(6)由图可看出:该实验的目的研究温度对c(FeO42-)(或FeO42-水解反应)的影响 。升高温度c(FeO42-)降低。说明升高温度,水解平衡向消耗该物质的方向移动。即升高温度,催进盐的水解。所以水解反应是吸热反应。故△H>0。2FeO4)的生产工艺及制取过程中涉及的化学反应原理的知识。
本题难度:困难
5、计算题 海水中溴常以NaBr形式存在,经分析海水中含溴0.07%,则海水中含NaBr的质量分数为_________________。从海水中提取溴的方法之一是:
①通入Cl2至浓缩的溴化物溶液,然后用空气把生成的溴吹出。
②Na2CO3溶液吸收溴(其中有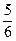 的溴的物质的量转化为Br-),同时放出CO2。
的溴的物质的量转化为Br-),同时放出CO2。
③向所得含溴化合物溶液中加稀H2SO4,溴又重新析出。
④得到的溴中可能夹杂少量的Cl2,再加入FeBr2除去。
第一步反应的离子方程式______________________________________________。
第二步反应的化学方程式______________________________________________。
第三步反应中氧化剂的化学式是________________________________________。
参考答案:0.09%
Cl2+2Br-====2Cl-+Br2
3Br2+3Na2CO3====5NaBr+NaBrO3+3CO2↑
NaBrO3
本题解析:先计算100 g海水中NaBr的质量。
m(NaBr)="0.07" g×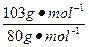 ="0.09" g
="0.09" g
海水中NaBr的质量分数为
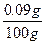 ×100%=0.09%
×100%=0.09%
本题难度:简单