微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是(?)
A.NaCl溶液
B.HCl溶液
C.稀NaOH溶液
D.酸性AgNO3溶液
参考答案:C
本题解析:用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2,这说明电解的实质是电解水,则选项C正确。A中电解产物是氯气、氢气和氢氧化钠,B中电解产物是氯气和氢气。D中电解产物是银、氧气和硝酸,答案选C。
点评:该题是高考中的常见考点和题型,属于中等难度的试题。试题综合性强,在注重对教材基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导和训练。该题的关键是明确电解的工作原理以及离子的放电顺序,然后灵活运用即可。
本题难度:简单
2、选择题 Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2Li+2SO2 Li2S2O4。下列说法正确的是
Li2S2O4。下列说法正确的是
[? ]
A. 该电池反应为可逆反应
B. 放电时,Li+向负极移动
C. 充电时,阴极的电极反应式为Li++e-=Li
D. 该电池的电解质溶液可以换成LiBr的水溶液
参考答案:C
本题解析:
本题难度:一般
3、选择题 某学生欲完成2HCl+2Ag==2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是
[? ]
A.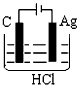
B.
C.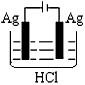
D.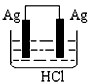
参考答案:C
本题解析:
本题难度:简单
4、填空题 氢气是一种清洁能源,氢气的制取与储存是氢气能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH =+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH =+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g)ΔH =+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用 的制氢方法。CH4(g)与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为_________________________
(2)H2S 热分解制氢时,常向反应器中通入一定比例空气,使部分 H2S 燃烧,其目的是________;燃烧生成的 SO2与 H2S 进一步反应,生成物在常温下均为非气体,写出该反应的化学方程式:___________________________
(3)H2O 的热分解也可得到 H2,高温下水分解体系中主要气体的体积分数与温度的关系如图甲所示。图中 A、B 表示的物质依次是______________________________________。
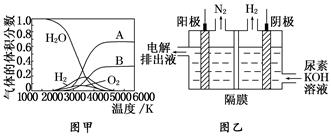
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图乙(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为_____________________
(5)Mg2Cu 是一种储氢合金。 350 ℃时,Mg2Cu 与 H2反应,生成 MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为 0.077)。Mg2Cu 与 H2反应的化学方程式为_____________________________________
参考答案:(1)CH4(g)+2H2O(g)=CO2(g)+4H2(g)ΔH=+165.0 kJ·mol-1
(2)为H2S热分解反应提供热量
2H2S+SO2=2H2O+3S(或4H2S+2SO2=4H2O+3S2)
(3)H、O(或氢原子、氧原子)
(4)CO(NH2)2+8OH--6e-=CO +N2↑+6H2O
+N2↑+6H2O
(5)2Mg2Cu+3H2△,MgCu2+3MgH2
本题解析:本题考查化学反应与能量,化学能与电能的转化及元素化合物相关知识,意在考查考生的综合运用能力。
(1)将所给反应依次编号为①②③,根据盖斯定律,由反应①×2-反应②即得题述反应的热化学方程式:CH4(g)+2H2O(g)=CO2(g)+4H2(g)ΔH=+165.0 kJ·mol-1。
(3)由图中A、B的体积分数比例近似为2∶1,则可确定A为H原子,B为O原子。
(4)H2是由溶液中的H+在阴极放电得到的,则阳极产生的是N2,阳极发生氧化反应,在碱性环境下的电极反应式为:CO(NH2)2+8OH--6e-=CO +N2↑+6H2O。
+N2↑+6H2O。
(5)由Mg2Cu变为MgCu2,可知Mg含量下降,则生成物中氢化物仅含的一种金属元素必为Mg,再根据其中氢的质量分数为0.077,则Mg与H物质的量之比为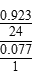 =
= ,即化学式为MgH2,则反应的化学方程式为:2Mg2Cu+3H2△,MgCu2+3MgH2。
,即化学式为MgH2,则反应的化学方程式为:2Mg2Cu+3H2△,MgCu2+3MgH2。
本题难度:困难
5、选择题 α-AgI是一种固体导体,导电率很高。为研究α-AgI到底是Ag+导电还是I—导电,设计了如下实验,下列有关说法不正确的是
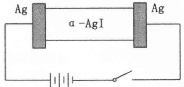
A.若α-AgI是Ag+导电,则通电一段时间后晶体质量不变
B.若α-AgI是Ag+导电,则通电一段时间后晶体质量减少
C.阳极反应为:Ag一e—=Ag+
D.阴极质量不断增加
参考答案:B
本题解析:若α-AgI是Ag+导电,阳极反应式为Ag一e—=Ag+,阳极质量减小;内电路中Ag+移向阴极,阴极反应式为Ag++e—=Ag,阴极质量增大;由电子守恒可知,阳极减小的质量等于阴极增加的质量,则α-AgI晶体的质量不变。
本题难度:一般