微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)氢是一种重要的非金属元素。氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)某硝酸厂处理尾气中NO的方法是:催化剂存在时用H2将NO还原为N2。
已知:
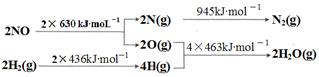
则H2还原NO生成氮气和水蒸气的热化学方程式是:
?。
(2)在一定条件下,用H2将二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2 (g)  CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)
向一容积为2 L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2mol·L一1,H2 0.8mol·L一1,CH40.8mol·L一1,H2O1.6mol·L一1。则CO2的平衡转化率为?。上述反应的平衡常数表达式K=?。200℃时该反应的平衡常数K=64.8,则该反应的△H?0(填“>’’或“<”)。
(3)某研究小组以H2与CaCl2制备某种钙的化合物。已知反应只生成甲、乙两种化合物。对产物分析发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为?。
②甲与水反应可得H2,其化学方程式是:
?。
(4)H2的获得途径很多,由哈工大研究小组设计的微生物电解有机废水法,既可以清除废水中的有机杂质,同时可以获得氢气。下图为一种处理含甲醇工业废水的微生物电解池,写出电解过程中,阳极发生的电极反应式:?。

2、计算题 加热N2O5,依次发生的分解反应为①N2O5(g) N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g) N2O(g)+O2(g),在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol·L-1,N2O3的平衡浓度为1.62 mol·L-1,求N2O5和N2O的平衡浓度。
N2O(g)+O2(g),在1 L密闭容器中充入4 mol N2O5,加热到t ℃,达到平衡状态后O2的平衡浓度为4.5 mol·L-1,N2O3的平衡浓度为1.62 mol·L-1,求N2O5和N2O的平衡浓度。
3、选择题 在10℃时某化学反应速率为0.1mol/(L·s),若温度每升高10℃反应速率增加到原来的2倍。为了把该反应速率提高到1.6?mol/(L·s),则该反应需在什么温度下进行
A.30℃
B.40℃
C.50℃
D.60℃
4、选择题 已知: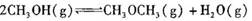
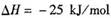 ,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加人CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加人CH3OH,反应到某时刻测得各组分的物质的量浓度如下:

下列说法正确的是
A. 平衡后升高温度,平衡常数>400
B. 平衡时,c(CH3OCH3)="1.6" mol/L
C. 平衡吋,反应混合物的总能量减少20kJ
D 平衡时,再加人与起始等量的CH3OH,达新平衡后CH3OH转化率增大
5、计算题 可逆反应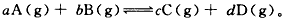 取amol A和b mol B置于VL容器中,1 min后,测得容器内A的浓度为xmol/L。求:
取amol A和b mol B置于VL容器中,1 min后,测得容器内A的浓度为xmol/L。求:
(1)此时B的物质的量浓度为多少?
(2)此时C的物质的量浓度为多少?
(3)v(A)为多少?