微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)下图是元素周期表的框架图(未标出元素周期表的边界),请根据下面提问回答表中指定元素的相关问题:
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ①
| ②
| ?
| ③
| ?
|
?
| ④
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑤
| ?
| ?
| ⑥
| ⑦
| ⑧
|
⑨
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)表中化学性质最不活泼的元素,其原子结构示意图为??。
(2)表中能形成两性氢氧化物的元素是??(用元素符号表示),写出该两性氢氧化物与⑦的氢化物的水溶液反应的离子方程式??。
(3)电子式表示④与⑦形成化合物的过程??。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是??
?(填酸的化学式)。
(5)⑥、⑦、⑨电子数相等的简单离子的半径由大到小依次为?(用元素符号表示)。
(6)④⑤两元素相比较,金属性较强的是?(填名称),可以验证该结论的实验是?(填编号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
参考答案:(10分) (1) 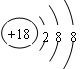 ?(2) Al? , Al(OH)3 + OH- = AlO2- +2H2O
?(2) Al? , Al(OH)3 + OH- = AlO2- +2H2O
(3)  ?
?
(4) HClO4?(5) S2- >Cl->K+?(6) 镁,? bc
本题解析:考查元素周期表都结构及元素周期律的应用。根据元素在周期表中的位置可知,①~⑩分别是C、N、F、Mg、Al、S、Cl、Ar、K、Br。
(1)中化学性质最不活泼的元素是稀有气体Ar,其原子结构示意图为 。
。
(2)表中能形成两性氢氧化物的元素是Al,氢氧化铝能溶于盐酸中,方程式为Al(OH)3 + OH- = AlO2- +2H2O。
(3)镁和氯气形成的是离子键,其形成过程为
 。
。
(4)非金属性越强,最高价氧化物的水化物中酸性。由于F没有含氧酸,所以应是高氯酸。
(5)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以顺序是S2- >Cl->K+。
(6)镁的金属性强于铝的。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数例外)。
6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。
7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
所以答案选bc。
本题难度:一般
2、计算题 3.2 g某元素A 的单质与氢气化合生成3.4 g气态氢化物H2A,已知A 的原子核中质子数和中子数相等,则:
(1) A的原子序数为?(2分)
(2) 元素A位于元素周期表中什么位置?(2分)
(3) 气态氢化物的化学式是什么?并书写气态氢化物的电子式(2分)
参考答案:
本题解析:略
本题难度:一般
3、选择题 短周期元素A、B、C在周期表中所处的位置如表所示。A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为次外层电子数的2倍。则下列说法正确的是
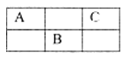
A.元素D形成的气态氢化物的分子构型一定是正四面体
B.A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
C.在DB2、BC6、DC4的分子中,每个原子都满足8电子稳定结构
D.四种元素形成的气态氢化物中,C元素形成的氢化物的稳定性最高
参考答案:D
本题解析:根据ABC三种元素在周期表中的相对位置可知,如果设A的原子序数是x,则B是x+9,C是x+2,则x+x+9+x+2=32,解得x=7,即A是N,B是S,C是F。D元素原子的最外层电子数为次外层电子数的2倍,因此D是碳元素。A、碳元素的氢化物乙烯是平面型结构,A不正确;B、氨气和硝酸反应是化合反应,且不是氧化还原反应。H2S和浓硫酸反应是氧化还原反应,反应类型不同,B不正确;C、在SF6分子中,S是+6价,F是-1价,所以S原子不满足8电子稳定结构,C不正确;D、非金属性越强,氢化物的稳定性越强,F是最活泼的非金属,HF的稳定性最高,D正确,答案选D。
本题难度:一般
4、选择题 下列各分子中,所有原子都满足最外层为8电子结构的是
A.NO2
B.BF3
C.CCl4
D.HCl
参考答案:C
本题解析:略
本题难度:简单
5、填空题 A、B、C、D为短周期中相邻两周期中的元素,其原子序数A>B>C>D,D和A形成简单离子后,它们的电子层相差两层,已知A处于第n族,D处于第m族,且A单质中含有共价键,B的气态氢化物的分子式为H2B,在其最高价氧化物中B的质量分数为40%,B原子核内质子数和中子数相等,C和A形成CA3型化合物,C与A、B在同一周期,B与A左右相邻,试回答:
(1)C离子的结构示意图为?[
(2)向B的氢化物的水溶液中滴入A单质的水溶液,发生反应的化学方程式为?.
(3)向A、C形成的化合物的水溶液中滴入氨水,其反应的离子方程式为___________________
参考答案:
(1)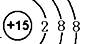

本题解析:略
本题难度:简单