微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知X、Y分别为同周期的ⅠA和VIA族的两种元素,它们的原子序数分别为a和b,则下列关系不可能成立的是(?)
A.a=b –15
B.a=b –29
C.a=b – 9
D.a=b –5
参考答案:C
本题解析:根据元素周期表中每一周前容纳的电子数可知,若属于第二或第三增强,则相差5.若是第四或第五周期,则相差15.若是第六周期。则相差29,所以选项C是不可能的,答案选C。
本题难度:简单
2、填空题 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原予序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如图。

请回答:
(1)A元素的名称是________________________;
(2)B元素原子核外运动状态不同的电子数为__________,C元素原子价电子层的电子排布图为_____________,B与A形成的化合物比C与A形成的化合物沸点高,其原因是_____________;
(3)元素E在周期表中的位置是______,它的+2价离子的电子排布式为____________;
(4)由以上五种元素的任意两种形成常见化合物中,所含离子键成分最多的可能为__________(填写化学式);
(5)如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是_______________(只要求列出算式)。
参考答案:(1)氢? (1分)
(2)9 (2分)? ?(2分)?
?(2分)?
HF分子间存在氢键,HCl分子间没有氢键(2分)
(3)第四周期第ⅦB族(2分)? 1s22s22p63s23p63d5或[Ar]3d5 (2分)
(4)CaF2? (2分)?(5)V = 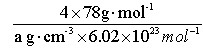 ?(2分)
?(2分)
本题解析:在前36号的元素中,符号周期表中1—18列中的第7列元素的是25号元素锰元素,即E是Mn。则D是Ca。由晶胞的结构可计算出还有的B和D的离子数,含有的D是8×1/8+6×1/2=4,B离子全部在晶胞内,故含有的B是8。所以化学式为DB2,Ca是+2价的,因此B是-1价的,则B可能是F或Cl。B和C属同一主族,原子序数小于C的,且均属于前36号元素,因此B只能是F,C则是Cl。A与其他4种元素既不在同一周期又不在同一主族,所以A是第一周期的氢原子。
(1)氢
(2)F元素元素原子核外有9的电子,因此就有9个运动状态不同的电子。Cl元素的价电子就是最外层电子,电子排布图为
B与A形成的化合物和C与A形成的化合物分别是HF和HCl,由于前者分子间含有氢键,而后者没有,所以其化合物的沸点高。
(3)根据构造原理可写出其+2价离子的电子排布式,即1s22s22p63s23p63d5或[Ar]3d5。
(4)金属性和非金属性越强,所形成的离子键成分越多,所以化学式为CaF2。
(5)因为1个晶胞中含有的Ca2+和F-分别是4和8,因此含有的CaF2的物质的量是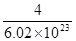 ,CaF2的摩尔质量是78g·mol-1,所以晶胞的体积是
,CaF2的摩尔质量是78g·mol-1,所以晶胞的体积是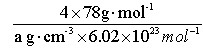
本题难度:一般
3、填空题 A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。A元素的一种核素质子数与质量数在数值上相等;B、E同主族,且核电荷数之比为1︰2;C的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子;D的最外层电子数是内层电子总数的一半。试回答下列问题:
(1)F位于周期表中第________周期________族。
(2)常温时,39 g B、C按原子个数比1︰l形成的化合物X与足量CO2反应放出Q kJ的热量,写出该反应的热化学方程式?;
写出少量X与FeCl2溶液反应的离子方程式_______________________________________。
(3)B、C、F组成的化合物Y是家用消毒剂的主要成分,Y的溶液呈碱性,用离子方程式解释其原因______________________________;起消毒作用的微粒电子式为_________。
(4)四原子分子Z与C的单质和水反应所得的阴离子电子数相等,Z的分子空间构型为___________型,它属于_________分子(填“极性”或“非极性”);请比较Z与DA3的沸点高低并加以解释_____________________________________________________。
(5)目前人们正在研究开发一种高能电池,它是以熔融的C、E单质为两极,以C离
子导电的β-Al2O3陶瓷作固体电解质,反应式为:2C+xE  ?C2Ex。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
?C2Ex。请写出电池放电时正负极的电极反应式,正极反应式:_______________________。用该电池作电源进行电解含有0.2 mol CuSO4和0.2 mol NaCl的混合溶液500 mL时:若此电池工作一段时间后消耗23 g C单质。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
参考答案:(1)三?ⅦA (各1分)?
(2)2Na2O2(s) + 2CO2(g) = 2Na2CO3(s) + O2(g);ΔH= -4Q kJ/mol
3Na2O2 + 6Fe2+ + 6H2O = 6Na+ + 4Fe(OH)3↓+ 2Fe3+(各2分)
(3)ClO-+ H2O  HClO + OH-
HClO + OH- ?(各2分)
?(各2分)
(4)三角锥(1分)极性(1分)NH3的沸点高于PH3,因为NH3分子间存在氢键(2分)
(5)xS+2e-=Sx2-?6.72 L?1(各2分)
本题解析:A元素的一种核素质子数与质量数在数值上相等,说明A是H;B、E同主族,且核电荷数之比为1︰2,B是O,E是S;C的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,C是Na,Na+和OH―电子数相同;D的最外层电子数是内层电子总数的一半,D是P。即A―H、B―O、C―Na、D―P、E―S、F―Cl。
(1)三?ⅦA?
(2)39 gNa2O2反应放出QkJ的能量,2molNa2O2与CO2反应放出4QkJ的能量,所以:
2Na2O2(s) + 2CO2(g) = 2Na2CO3(s) + O2(g);ΔH= -4Q kJ/mol
3Na2O2 + 6Fe2+ + 6H2O = 6Na+ + 4Fe(OH)3↓+ 2Fe3+
(3)ClO-+ H2O  HClO + OH-?
HClO + OH-? ?
?
(4)三角锥(1分)极性(1分)NH3的沸点高于PH3,因为NH3分子间存在氢键(2分)
(5)xS+2e-=Sx2-? ;先后发生下列2个反应:
CuCl2 Cu+Cl2↑,? 2e―?
Cu+Cl2↑,? 2e―?
0.1mol? 0.1mol? 0.2mol?
2CuSO4+2H2O 2 Cu?+O2↑+ H2SO4 ?4e―
2 Cu?+O2↑+ H2SO4 ?4e―
0.1mol? 0.05mol? 0.1mol? 0.2mol
2H2O 2H2↑+O2↑? 4e―
2H2↑+O2↑? 4e―
0.15mol? 0.6mol
阳极共产生0.1mol+ 0.05mol+ 0.05mol="0.3mol," 即6.72 L气体;共产生0.1molH2SO4, 加水稀释至2 L,氢离子的浓度为:0.1mol×2/2L=0.1mol/L,PH= 1 。
本题难度:一般
4、填空题 (5分)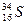 微粒中的质子数是??,中子数是??,核外电子数是??。它与
微粒中的质子数是??,中子数是??,核外电子数是??。它与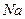 形成的化合物的电子式??,此化合物类型??(填“离子化合物”或“共价化合物”)。
形成的化合物的电子式??,此化合物类型??(填“离子化合物”或“共价化合物”)。
参考答案:16;18;16;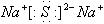 ;离子化合物?(每空1分)
;离子化合物?(每空1分)
本题解析:略
本题难度:简单
5、选择题 已知下列元素的原子半径:
元素
| N
| S
| O
| Si
|
原子半径/10?10 m
| 0.75
| 1.02
| 0.74
| 1.17
|
根据以上数据,磷元素的原子半径可能是(? )
A.0.80×10?10 m?B.1.10×10?10 m
C.1.20×10?10 m?D.0.70×10?10 m
参考答案:B
本题解析:因为同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大。所以磷原子的半径大于硫原子和氮原子的,但小于硅原子的,所以选项B正确。答案选B。
本题难度:一般